Questa esperienza rappresenta una unità didattica completa, che presenta alcuni esempi di possibili cambiamenti nella struttura degli aggregati di atomi che si verificano nelle trasformazioni chimiche e costituisce un supporto per rendere trasferibile e ripetibile l’esperienza, nell’ambito di un percorso più completo sulla struttura della materia, che parte dal modello particellare.
Prerequisiti
Nozioni di base riguardo a:
- modello particellare
- concetti di atomo, molecola, elemento e composto
- concetti di miscuglio, soluzione e sostanza chimica.
Obiettivi
- Costruire delle rappresentazioni degli aggregati atomici e delle loro trasformazioni.
- Esplorare e classificare i diversi possibili modi di ri-assemblarsi di tali aggregati.
- Riconoscere le evidenze delle trasformazioni delle sostanze nei fenomeni chimici.
- Stabilire un’associazione tra le immagini mentali dei cambiamenti degli aggregati di atomi e i rispettivi cambiamenti delle proprietà delle sostanze coinvolte nelle trasformazioni chimiche.
Materiali
- Costruzioni Lego di almeno 4 colori (le “Duplo” sono meglio visibili e più facilmente smontabili).
- Per la reazione zinco + iodio: limatura di zinco granulare (non in polvere), iodio a cristalli o soluzione di tintura di iodio, aceto, provetta con tappo a vite o altro recipiente trasparente che si possa chiudere.
- Per la reazione di decomposizione dell’acqua ossigenata: acqua ossigenata al 3 %, biossido di manganese (polvere nera contenuta nelle pile a secco), palloncino di gomma, bottiglia o beuta da 125 mL.
- Per la reazione di decomposizione dello ioduro di zinco: una pila da 9 V con portapile e due lamine di rame, un recipiente largo (per esempio piastra Petri), ioduro di zinco preparato precedentemente o una sua soluzione.
- Per la reazione alluminio + cloruro rameico: lamina di alluminio (per esempio presa da una casseruola di alluminio per forno), cloruro rameico, acqua distillata; se si dispone di solfato rameico (più facilmente reperibile) si può sciogliere prima il sale da cucina nell’acqua distillata per avere la stessa reazione.
- Per la reazione bicarbonato + aceto: bottiglia, palloncino di gomma, aceto, bicarbonato di sodio, cucchiaio, cartina del pH.
Concetti fondamentali
Una sostanza corrisponde a un aggregato di atomi. Negli elementi gli aggregati contengono solo atomi dello stesso tipo.
 |
 |
 |
| a) Elemento con atomi non aggregati | b) elemento con atomi associati a coppie | c) elemento con atomi aggregati in una struttura compatta |
Nei composti ci sono invece ripetizioni regolari di abbinamenti tra atomi diversi.
 |
 |
 |
| a) Aggregazioni di due atomi diversi formano le molecole di un composto AB | Un composto AB formato da due elementi diversi dal precedente] | c) Composto formato da un aggregato compatto di atomi disposti regolarmente |
 |
 |
 |
| d) Molecole uguali di un composto AB2 | d) Aggregazione solida degli atomi in un composto di tre elementi | e) altro composto solido formato da atomi di due elementi |
In ogni caso, se gli atomi si uniscono a formare gruppetti separati l’uno dall’altro, tali aggregati si chiamano molecole. È importante precisare non solo quali atomi formano le molecole, ma anche come sono disposti. Le molecole di destra nell'immagine qui sotto sono diverse da quelle di sinistra, e le corrispondenti sostanze avranno proprietà diverse.

Se si modificano il numero e la disposizione degli atomi negli aggregati, cioè se si modifica il loro modo di stare uniti, cambiano tutte le proprietà della sostanza, comprese quelle che possiamo vedere con i nostri occhi.
Una sostanza ha numerose proprietà. La seguente tabella mostra le proprietà di due composti: l’acido acetico (principale componente dell’aceto) e il bicarbonato di sodio.
| Proprietà | Acido acetico | Bicarbonato di sodio |
| Stato fisico a 20 °C | Liquido | Solido |
| Effetto del riscaldamento | Fonde a 16 °C e bolle a 118 °C | Si decompone liberando anidride carbonica a 270 °C trasformandosi in carbonato di sodio |
| Solubilità in acqua | Illimitata | 90 grammi/litro |
| Solubilità in alcol | Illimitata | Insolubile |
| Densità | 1,05 g/cm3 | 2,16 g/cm3 |
| Colore con la cartina del pH | Rosso (acido) | Blu (basico) |
| Reazione con aceto | --- | Sviluppa effervescenza |
| Reazione con bicarbonato | Sviluppa effervescenza | --- |
Le particelle singole non possiedono quasi nessuna di queste proprietà: un singolo atomo non può essere né solido né liquido né gassoso, non fonde né bolle, non si scioglie e non ha colore. Queste sono tutte proprietà che possono avere solo gli aggregati formati da molte particelle, non i singoli atomi o le singole molecole.
Le ultime tre proprietà della tabella e la capacità di decomporsi a caldo del bicarbonato sono proprietà chimiche, perché riguardano la capacità di originare nuove sostanze.
Nelle trasformazioni chimiche si modifica il modo di aggregarsi degli atomi e perciò emergono nuove sostanze, i prodotti, con proprietà completamente diverse da quelle delle sostanze iniziali, i reagenti. Le prove più comuni e visibili di queste trasformazioni sono:
- cambiamenti di colore
- formazione di bollicine (effervescenza)
- formazione o scomparsa di solidi unendo due liquidi
- aumento o diminuzione della temperatura
Qualsiasi cambiamento delle proprietà può essere in genere associato alla comparsa o alla scomparsa di una sostanza. Fanno eccezione i passaggi di stato e la formazione di soluzioni, in cui si possono verificare cambiamenti di colore, formazione o scomparsa di solidi o gas e cambiamenti di temperatura senza che si formino nuove sostanze. In questo tipo di trasformazioni, chiamate trasformazioni fisiche, le sostanze coinvolte conservano alcune proprietà e inoltre esse possono essere recuperate nella forma iniziale, ripristinando le condizioni di temperatura e pressione iniziali o eliminando il solvente se erano state sciolte.
Ma cos’è che provoca le trasformazioni chimiche? Ovvero, perché semplicemente associando due sostanze, o somministrando energia a una sola sostanza, si innesca la formazione di nuove sostanze?
Il modello particellare fornisce due indizi per rispondere a questa domanda. Secondo tale modello le particelle sono soggette a un movimento tanto più frenetico quanto maggiore è la temperatura. Il semplice riscaldamento di una sostanza può quindi provocare la frammentazione in aggregati più piccoli. Il modello particellare prevede inoltre che le particelle e gli atomi si attraggano, cioè abbiano affinità gli uni per gli altri. L’agitazione termica garantisce una certa libertà, agli atomi degli aggregati, di staccarsi parzialmente per “esplorare” nuove combinazioni, alcune delle quali daranno attrazioni più forti. Si può dire che un sistema chimico somiglia ad una sala da ballo, dove entrano molte coppie che possono sperimentare nuovi partner, e dalla quale escono coppie diverse e più “affiatate”. Vediamo ora il comportamento di alcuni sistemi chimici.
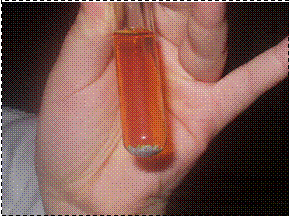
Reazione zinco + iodio
Introdurre nel recipiente circa 1 g di zinco, circa 5 mL di acqua e infine circa 1 g di iodio solido. Se non si dispone di questo è possibile sostituire l’acqua con la tintura di iodio. Aggiungere qualche goccia di aceto. Chiudere la provetta ed agitare a lungo.
Se si parte da zinco solido, il liquido prima diventerà più scuro, divenendo simile alla tintura di iodio. Lo iodio in soluzione reagirà più rapidamente con lo zinco e dopo circa 5 minuti si osserverà una rapida decolorazione, fino a un colore giallo chiaro.
La soluzione può essere travasata in un becher, lasciando l’eccesso di zinco nella provetta, e fatta evaporare su una piastra termica fino a isolare il prodotto dell’unione dei due elementi, cioè il composto ioduro di zinco.
| Il fenomeno in concreto | Il modello |
|
|
|
| Con l’evaporazione dell’acqua le particelle del composto di iodio e zinco possono aggregarsi e formare un solido. A destra modello di ioduro di zinco solido. |  |
Altri sistemi chimici che seguono lo stesso modello sono, per esempio, la combustione del magnesio e la formazione della ruggine.
Reazione alluminio + cloruro rameico
Sciogliere due cucchiaini rasi di cloruro di rame in mezzo bicchiere di acqua distillata, per avere una soluzione limpida. Introdurre nella soluzione una lastrina di alluminio, ottenuta ritagliandola da una casseruola in tale materiale. Da notare che il foglio di alluminio per avvolgere gli alimenti è troppo sottile e si disgrega completamente, quindi l’eccesso di tale elemento non può essere separato facilmente a fine reazione.
Osservare tutti i fenomeni che accompagnano la trasformazione. In questa trasformazione un elemento ne sostituisce un altro combinato in un composto, producendo un nuovo composto e un altro elemento.
Una reazione secondaria, dello stesso tipo, interessa l’alluminio (elemento) e l’acqua (composta da idrogeno e ossigeno): l’alluminio sostituisce l’idrogeno e si combina con l’ossigeno. L’idrogeno, rimasto senza “partner”, si libera sotto forma di bollicine.
 |
 |
 |
|
| Chiave: bianco = alluminio, giallo = cloro; rosso = rame. | |
Decomposizione dell'acqua ossigenata
In una bottiglietta introdurre metà volume di acqua ossigenata (perossido di idrogeno) al 3%. Si può notare che da tale soluzione si liberano alcune bollicine (il disinfettante scade e perde di efficacia dopo uno o due anni). Aggiungere poi un cucchiaino di polvere nera di biossido di manganese. Chiudere subito il collo della bottiglia con un palloncino di gomma e agitare.
Il gas prodotto farà gonfiare il palloncino. Facendo uscire un po’ di tale gas e dirigendolo su un pezzetto di legno incandescente appena spento, si ravviverà la combustione. La capacità di ravvivare la combustione è una proprietà dell’ossigeno, prodotto dalla decomposizione dell’acqua ossigenata.
Il biossido di manganese ha solo la funzione di accelerare la decomposizione dell’acqua ossigenata, che si verifica anche spontaneamente. Il biossido di manganese non si trasforma in altre sostanze, infatti, una volta terminata l’effervescenza, si può recuperarlo e utilizzarlo quante volte si desidera con altra acqua ossigenata.
In questa reazione accade che un composto si suddivide in un composto più semplice e in un elemento.
| Il fenomeno in concreto | Il modello |
 |
acqua ossigenata
acqua + ossigeno |
In genere le reazioni di decomposizione sono provocate dalla somministrazione di energia (termica, elettrica, luminosa) come nel caso della decomposizione dello ioduro di zinco.
Decomposizione dello Ioduro di zinco (con elettricità)
Sciogliere in un becher o in una piastra di Petri lo ioduro di zinco ottenuto dalla reazione tra iodio e zinco, o usare direttamente la soluzione di questo composto ottenuta nell’esperienza sopra descritta. Immergervi due lamine di rame collegate al polo positivo e negativo di una batteria da 9 V.
Al polo positivo si formerà la colorazione bruno-rossiccia dello iodio, al polo negativo si formeranno dei cristalli lucenti metallici e grigi, di zinco. Quindi gli stessi due elementi possono essere uniti in un composto e poi separati fornendo energia.
| Il fenomeno in concreto | Il modello |
|
Dalla soluzione del composto si rigenerano gli elementi iodio (al polo positivo, rosso) e zinco metallico (al polo negativo, nero). |
|
Reazione acido acetico + bicarbonato di sodio
In una bottiglietta introdurre due cucchiai di bicarbonato di sodio, versarvi aceto senza superare la metà del volume e chiudere subito con il palloncino di gomma. Il gas prodotto lo gonfierà.
Quando la reazione è terminata il liquido non conterrà più acido acetico. Senza far sgonfiare il palloncino scaricare il liquido e verificare con la cartina indicatrice che esso non è più acido come l’aceto iniziale. Aggiungere altro aceto e richiudere con lo stesso palloncino, che si gonfierà ulteriormente del gas sviluppato (anidride carbonica). Il liquido ottenuto, separato dal bicarbonato in eccesso, può essere evaporato. Si otterrà una sostanza che non ha più la capacità di dare effervescenza con acido acetico: l’acetato di sodio.
In questa reazione da due composti si originano altri due composti. Fanno parte di questa categoria tante altre reazioni, come quella tra cloruro rameico e idrossido di sodio, in cui si forma cloruro di sodio (sale da cucina) e idrossido rameico, un solido blu insolubile in acqua.
| Il fenomeno in concreto | Il modello |
 |
|
| L’anidride carbonica ha formula CO2 e nel modello dei prodotti la sua molecola corrisponde al mattoncino nero con due rossi. Il bicarbonato di sodio, formato da quattro elementi, ha struttura più complessa. | |
Ioduro di mercurio (riscaldato)
Questo composto rosso vivo, se riscaldato sopra i 130 °C, subisce un riarrangiamento interno dei suoi atomi.
Alla nuova disposizione corrisponde una evidente diversa proprietà: il colore che diviene giallo. A temperatura ambiente si rigenera l’aggregazione atomica originaria e il colore torna rosso.
Lo ioduro di mercurio è ottenibile per combinazione diretta degli elementi iodio e mercurio.
| Il fenomeno in concreto | Il modello |
|
Composto HgI2 in condizioni normali, a temp. ambiente |
 |
|
Riscaldandolo a più di 127 °C si modifica il modo di stare insieme dei suoi atomi e cambiano le sue proprietà, compreso il colore e la densità (5% meno denso) |
 |
|
A temperatura ambiente, a poco a poco, si ripristina l’arrangiamento iniziale, più compatto. A destra il modello presenta alcune zone compatte e altre che devono ancora riarrangiarsi |
 |
Tutte le reazioni chimiche descritte, tranne l’ultima, sono state realizzate dal tutor Alfredo Tifi presso la seconda media dell’Istituto Comprensivo di Appignano il 28 maggio 2004, con l’insegnante Valeria Bellucci.