Cosa abbiamo imparato in quest’anno di pandemia della risposta immunitaria specifica contro SARS-CoV-2, sia quella indotta dai vaccini che dall’infezione naturale? Passando in rassegna gli studi condotti finora, Guido Poli ed Elisa Vicenzi spiegano come la produzione di anticorpi specifici, base immunologica dei vaccini, sembri poter giocare un ruolo peggiorativo in coloro che hanno contratto l’infezione. I motivi non sono ancora del tutto noti ma, per contro, la risposta specifica dei linfociti T sembra essere la miglior difesa del sistema immunitario contro la progressione di malattia.
Poco più di un anno fa il pianeta entrava nel tunnel della Covid-19, chiamato inizialmente “nCOV-19” e poi, definitivamente, SARS-CoV-2 per rimarcarne la stretta parentela col primo coronavirus umano a potenziale pandemico, il virus della SARS (Severe Acute Respiratory Syndrome) che causò “solo” 8.096 infezioni e 774 morti nel mondo nei primi sei mesi del 2003, per poi scomparire.
I numeri della pandemia sono impietosi: quasi 140 milioni di persone infettate e una letalità globale di quasi 3 milioni (2,1%).
La miglior notizia di questi ultimi mesi è l’allestimento in tempo record di vaccini straordinariamente efficaci basati sulla tecnologia di inoculazione di un semplice RNA messaggero (mRNA) incapsulato in nanoparticelle lipidiche che lo proteggono dalla degradazione e fungono da adiuvanti per potenziare la risposta immunitaria. L’mRNA vaccinale codifica per la proteina virale di superficie nota come spike, stimolando la produzione di anticorpi specifici, tra cui alcuni neutralizzanti che proteggono dall’infezione.
Ai due vaccini basati su mRNA prodotti da Pfizer/BioNtech e Moderna si è poi aggiunto, in Europa, il vaccino di AstraZeneca, basato sull’espressione della proteina spike con la metodologia più tradizionale dei vettori adenovirali e, a breve, è atteso l’inizio della vaccinazione con un vaccino simile (ma che richiede una sola dose) prodotto dalla Johnson & Johnson. Molti altri vaccini sono allo studio e verosimilmente affiancheranno nei prossimi mesi quelli già disponibili.
La notizia peggiore è che da alcuni mesi il virus si sta diversificando in varianti spesso più contagiose e in qualche caso probabilmente più aggressive; le varianti si generano spontaneamente, ma la pressione immunitaria da parte degli anticorpi sia indotti dai vaccini sia prodotti naturalmente dalle persone infettate può contribuire a favorirne la selezione e la diffusione (quando gli anticorpi non sono prodotti in concentrazione sufficiente a bloccare l’infezione). La sfida della competizione tra la capacità di vaccinare la popolazione generale e il virus e le sue varianti entra nel vivo; la speranza è di uscirne vincitori entro la fine di quest’anno.
Altra notizia negativa è che dopo un anno non è ancora disponibile un vero farmaco antivirale (il che non deve sorprendere: il primo farmaco anti-HIV arrivò cinque anni dopo la descrizione dei primi casi di AIDS e la prima terapia di combinazione veramente efficace dopo quindici!) con la possibile eccezione degli anticorpi monoclonali anti-spike da somministrare nei primi giorni dalla comparsa dei sintomi per bloccare la progressione di malattia: ancora troppo poco.
Ma cosa abbiamo imparato in quest’anno di pandemia della risposta immunitaria specifica (adattiva) contro il virus pandemico, sia quella indotta dai vaccini che dall’infezione naturale? Nella tabella qui sotto elenchiamo le cellule immunitarie responsabili della risposta immunitaria adattiva.

I linfociti B e gli anticorpi anti-SARS-CoV-2, una lama a doppio taglio
La risposta immunitaria specifica, o adattiva, è quella riferita all’attività esclusiva dei linfociti B e T ed è distinta da quella cosiddetta innata, evolutivamente più antica, in cui rientrano molte cellule, fattori solubili e la risposta infiammatoria.
L’elemento più distintivo e anche più facile da misurare della risposta adattiva a un’infezione virale è la produzione di anticorpi specifici, tra cui alcuni con capacità neutralizzante. Gli anticorpi neutralizzanti in generale si legano alle proteine virali deputate all’interazione con recettori di superficie (anche se non tutti i virus ne sono dotati) interferendo col meccanismo di ingresso virale e quindi bloccando il processo infettivo sul nascere.
Nel caso di SARS-CoV-2 (come anche di SARS-CoV-1) il recettore d’ingresso è l’enzima angiotensin converting enzyme-2 (ACE-2) a cui si lega la proteina spike del virus. ACE-2 interagisce con la proteina spike attraverso il suo receptor-binding domain (RBD) che promuove l’internalizzazione nella cellula del virus, grazie all’intervento di altre proteasi cellulari come la transmembrane protease, serine 2 (TMPRSS-2) o favorendone l’endocitosi. È quindi possibile che gli anticorpi neutralizzanti siano in grado di interferire col processo infettivo riconoscendo siti di interazione della proteina spike con queste proteasi.
Come anticipato, la produzione di anticorpi neutralizzanti anti-spike è l’obiettivo dei vaccini già in uso in tutto il mondo. Analogamente, studi recenti (qui, qui e qui) hanno dimostrato che gli anticorpi prodotti dall’infezione naturale conferiscono una protezione efficace all’80% per almeno alcuni mesi rispetto dalla reinfezione con lo stesso virus.
Tuttavia, in chi si è infettato, la produzione di anticorpi neutralizzanti non sempre protegge dallo sviluppo della malattia grave, ma addirittura può favorirla (figura 2), come anche suggerito da uno studio recente dell’IRCCS Lazzaro Spallanzani. Questo potrebbe spiegare anche il fatto che l’utilità terapeutica degli anticorpi monoclonali anti-spike sia limitata ai primi giorni dalla comparsa dei sintomi.
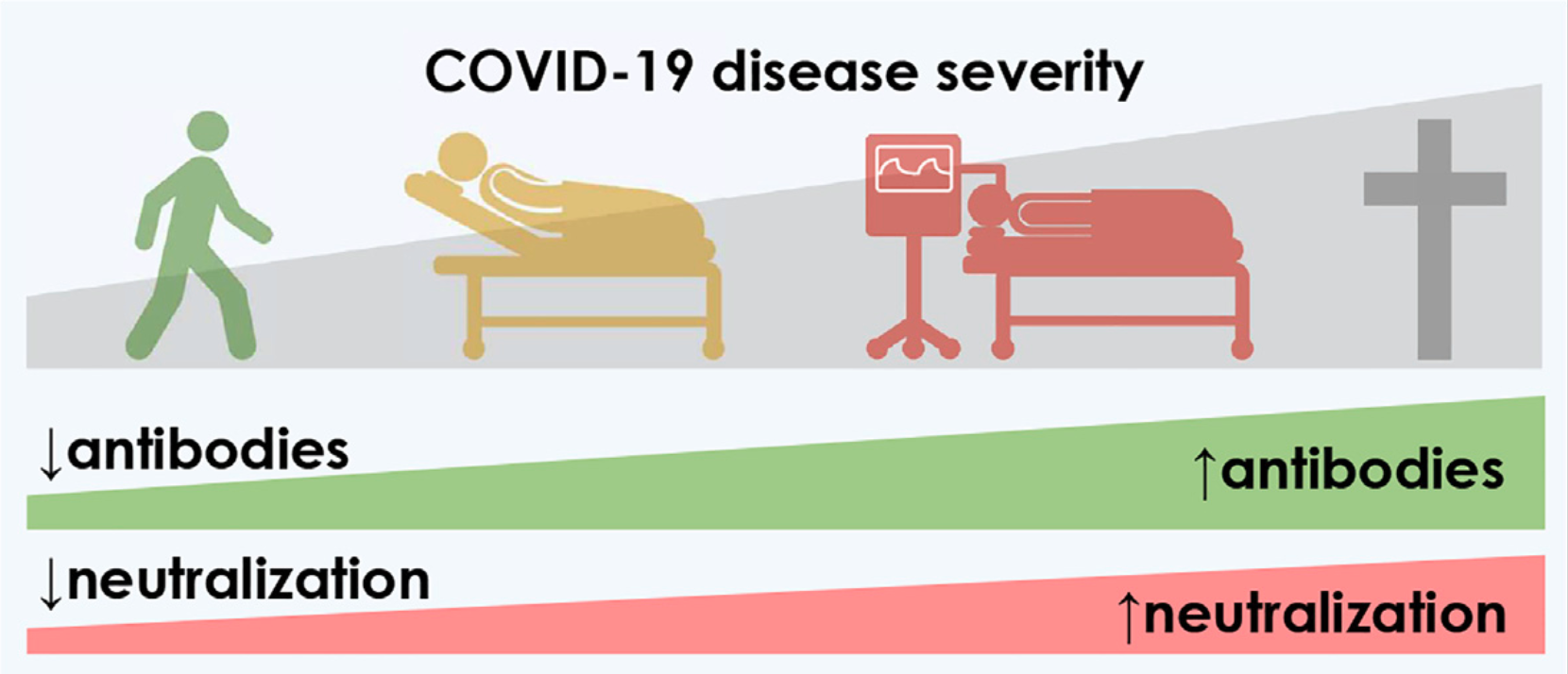
Figura 1. La malattia COVID-19 grave è associata a una maggiore secrezione di anticorpi neutralizzanti. La potenza di neutralizzazione anticorpale predice la gravità della malattia e la sopravvivenza per motivi ancora non chiariti. L’immagine è adattata da qui.
I primi studi sulla risposta anticorpale a SARS-CoV-2 hanno rivelato un aspetto inatteso: solo un terzo ca. delle persone infettate avevano risposto producendo immunoglobuline di tipo M, IgM, mentre nei rimanenti due terzi erano presenti solo IgG o una miscela di IgM e IgG. Questa osservazione era paradossale, in quanto i primi anticorpi secreti in risposta a un patogeno o a un vaccino sono, appunto, le IgM, mentre le IgG caratterizzano la fase “matura” della risposta immunitaria. Infatti, la produzione di IgG (e di eventuali altre classi di anticorpi quali le IgA o le IgE) comporta la sostituzione del “gambo” dell’anticorpo delle IgM mantenendo inalterata la porzione che lega l’antigene, processo che non può avvenire senza la cooperazione tra i linfociti B e i linfociti T CD4+ specifici a funzione cosiddetta helper.
La spiegazione più plausibile di questo apparente paradosso deriva da diversi studi sulla risposta dei linfociti T CD4+ al virus, dimostrabile nel 100% delle persone infettate, ma anche in una frazione rilevante (circa 20-30%) di persone che sicuramente non possono essere state infettate da SARS-CoV-2, dato che l’analisi è stata condotta su cellule collezionate prima del 2019. In questi casi, poiché i coronavirus umani più patogenici (SARS-CoV-1, SARS-CoV-2 e MERS) fanno parte della sottofamiglia dei beta-coronavirus che comprendono virus di varia patogenicità, da quello del comune raffreddore a quelli OC43 e HKU1, la risposta dei linfociti T CD4+ era verosimilmente diretta ad antigeni di questi altri beta-coronavirus, generando così una “reattività crociata” con SARS-CoV-2.
Per contro, altri studi hanno dimostrato che la maggioranza degli anticorpi prodotti in seguito all’infezione non sono prodotti da linfociti B cross-reattivi ad altri beta-coronavirus. Come conciliare queste osservazioni apparentemente contrastanti?
Studi recenti hanno messo in luce che la risposta iniziale dei linfociti B (e degli anticorpi secreti di conseguenza) all’infezione è sincrona e bimodale: essi, da un lato, producono ex novo anticorpi specifici per la proteina spike di SARS-CoV-2, ma dall’altro attivano una risposta crociata (di memoria) verso proteine di altri beta-coronavirus stagionali, risposta che tende a svanire nel tempo. Dopo alcuni mesi, infatti, si consoliderebbe una produzione stabile di anticorpi neutralizzanti prodotti da linfociti B memoria specifici per SARS-CoV-2 e non cross-reattivi (figura 3). L’analisi sistematica della produzione anticorpale (systems serology) suggerisce che questo aspetto bimodale della produzione anticorpale riguarda le persone adulte e anziane, mentre bambini i produrrebbero quasi esclusivamente anticorpi specifici per SARS-CoV-2. Tuttavia, uno studio indipendente suggerisce lo scenario opposto, ovvero che nei bambini vi sia una più alta frequenza di linfociti B cross-reattivi. L’argomento rimane quindi controverso e ulteriori studi saranno necessari per definire il ruolo delle risposte immunitarie crociate ad altri beta-coronavirus.
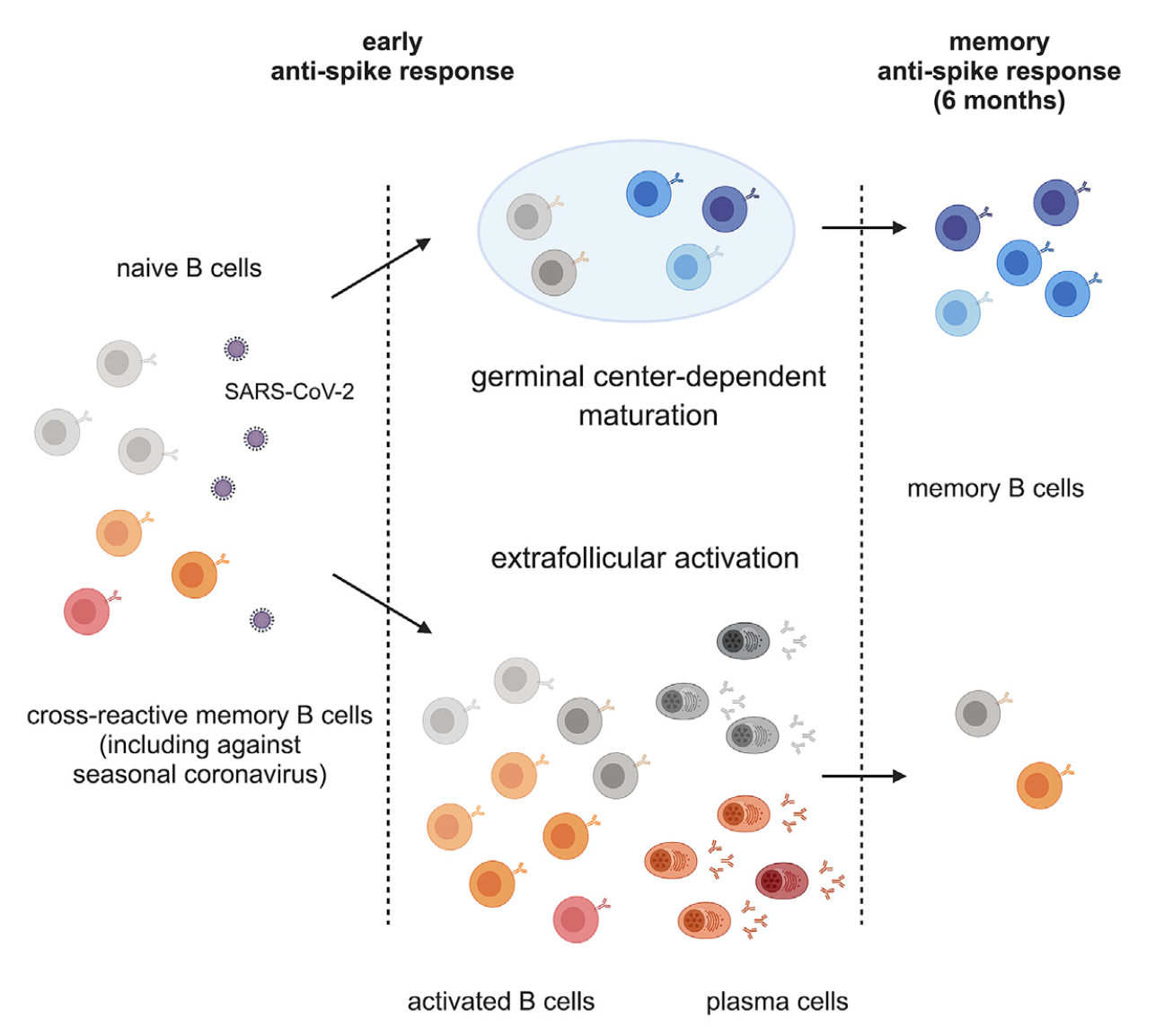
Figura 2. Risposta bimodale dei linfociti B all’infezione da SARS-CoV-2. L’infezione attiva contemporaneamente una risposta di linfociti B memoria per la produzione di Ab contro altri β-coronavirus ed una risposta specifica contro SARS-CoV-2, con maturazione delle cellule nei centri germinativi dei linfonodi, e produzione di Ab prevalentemente anti-Spike di SARS-CoV-2. Immagine presa da qui.
Vi è un altro aspetto rilevante della risposta dei linfociti B, e della produzione di anticorpi che ne è la conseguenza, ovvero la secrezione di anticorpi auto-reattivi che neutralizzano gli interferoni di tipo 1. Questi auto-anticorpi sono stati riscontrati in circa il 10% dei pazienti gravi, quasi esclusivamente maschi. È importante sottolineare che la produzione di auto-anticorpi, già evidenziata in altre patologie, è osservata in meno dell’1% della popolazione sana a prescindere dall’infezione da SARS-CoV-2, di cui rappresenta un fattore di aggravamento, perché sopprime gli effetti antivirali degli interferoni.
La risposta protettiva dei linfociti T
Oltre a consentire la produzione di anticorpi, le nanoparticelle lipidiche dei vaccini veicolano il loro contenuto a mRNA nelle cellule dendritiche mieloidi (figura 3). Queste sono cellule chiave della risposta immunitaria specifica, perché sono in grado di innescare la risposta primaria dei linfociti T CD4+ quando un nuovo patogeno o un nuovo vaccino viene introdotto nell’organismo.
Grazie a uno specifico recettore di superficie detto “T cell receptor (TCR)”, i linfociti T CD4+ riconoscono la presenza di frammenti di proteine virali (peptidi) esposti da specifiche proteine definite “complesso maggiore d’istocompatibilità di classe seconda” (MHC-II) presenti sulla superficie delle cellule dendritiche mieloidi, potenziano e migliorano la qualità degli anticorpi secreti dai linfociti B, stimolando la diversificazione delle classi anticorpali (dalle IgM iniziali alle IgG ed eventualmente le IgA e IgE) e l’aumento della loro affinità per l’antigene (fino a 10 000 volte!).
Diversi studi (qui e qui) supportano fortemente l’ipotesi che i linfociti T CD4+ esercitino un ruolo protettivo sulla progressione della malattia, verosimilmente coadiuvati dai linfociti T CD8+. Questi ultimi hanno infatti “licenza di uccidere” (e sono definiti per questo “citotossici”) qualsiasi cellula del nostro corpo sia infettata da un virus.
Conclusioni
La risposta immunitaria specifica al nuovo virus pandemico SARS-CoV-2 è fondamentale per il controllo dell’infezione naturale. La produzione di anticorpi specifici, in particolare contro la proteina spike, è la base immunologica dei vaccini allestiti in meno di un anno dalla comparsa del virus. Tuttavia, questi stessi anticorpi sembrano poter giocare un ruolo peggiorativo in coloro che hanno contratto l’infezione, per motivi ancora non pienamente compresi.
Per contro, la risposta specifica dei linfociti T CD4+, e probabilmente dei linfociti T CD8+, sembra essere la miglior difesa del sistema immunitario contro la progressione di malattia. La definizione ulteriore dei meccanismi protettivi o peggiorativi della risposta immunitaria specifica contro il virus saranno sicuramente oggetto di ulteriori studi. Sarà anche importante approfondire il ruolo della risposta crociata contro beta-coronavirus diversi da SARS-CoV-2 e definire la durata della risposta immunitaria indotta dai vaccini, per il momento stimate in diversi mesi, per capire se dovremo prepararci a ricevere un richiamo vaccinale ogni anno (eventualmente anche verso varianti virali) o meno.

