Negli ultimi decenni si sono diffusi
metodi di trattamento dei tumori attraverso irradiamento e detti,
collettivamente, di adroterapia. Le particelle utilizzate non sono
fotoni ma adroni, le particelle nucleari fatte di quark. Gli adroni
più utilizzati sono i protoni, nuclei dell’atomo di idrogeno, e
gli ioni carbonio, nuclei dell’atomo di carbonio privati dei loro 6
elettroni.
Gli adroni elettricamente carichi,
essendo pesanti, sono poco deflessi negli urti con i componenti dei
tessuti e hanno quindi un percorso praticamente rettilineo nella
materia attraversata. La loro carica elettrica ionizza le molecole
dei tessuti lasciando la maggior parte delle propria densità di
energia negli ultimi centimetri del percorso ed il punto di arresto
si chiama “picco di Bragg”: essi sono quindi in grado di
danneggiare preferenzialmente i tessuti malati in quanto cedono
energia là dove si trova il tumore. Per merito del “picco di
Bragg”, protoni accelerati a 200 MeV e ioni carbonio accelerati a
4800 MeV permettono di irradiare i tumori profondi (fino a 25 cm
sotto la pelle) seguendone il contorno con precisione millimetrica e
risparmiando i tessuti sani molto più di un fascio di raggi X.
Pertanto l’adroterapia è meno invasiva della radioterapia
tradizionale e risulta indicata per un numero sempre maggiore di
tumori. I trattamenti di adroterapia sono però 2-3 volte più
costosi in quanto gli adroni carichi sono particelle subatomiche
difficili da accelerare perché migliaia di volte più pesanti degli
elettroni che producono i raggi X nei linac, gli acceleratori
lineari.
Figura 1
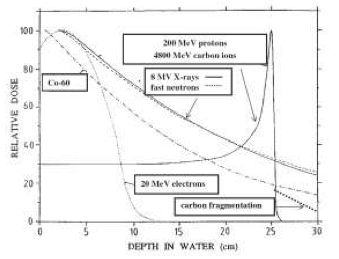
Dipendenza dalla profondità della dose depositata per differenti campi di irradiazione. Grazie al picco di Bragg, la distribuzione della dose di adroni carichi è molto più favorevole di quella prodotta coi raggi X.
BOX 1 | Ioni e
protoni
Ogni nucleo
cellulare traversato uno ione carbonio rilascia un’energia 24 volte
maggiore di quella rilasciata da un protone di uguale percorso in
quanto le distribuzioni energetiche lungo i percorsi sono simili e le
energie iniziali stanno nel rapporto 4800/200. Le ionizzazioni delle
molecole della cellula prodotte da protoni e raggi X sono lontane le
une dalle altre e causano per lo più rotture singole della doppia
elica del DNA, che sono nella maggior parte dei casi immediatamente
riparate dai meccanismi cellulari preposti alla sopravvivenza delle
cellule. Invece, negli ultimi centimetri di percorso, gli ioni
carbonio producono in media più di una ionizzazione nello spessore
della molecola di DNA producendovi molte rotture doppie vicine di
entrambe le eliche e danni localizzati. Questi danni complicati non
sono quasi mai riparati, specialmente dove si trova il bersaglio
tumorale. Gli ioni carbonio hanno quindi una maggiore efficacia
radiobiologica. Per questo essi sono in grado di “controllare”
anche le cellule di quel 10% dei tumori che sono radioresistenti sia
ai protoni che ai raggi X. I vantaggi
potenziali dovuti alla maggior conformità degli adroni e, nel caso
degli ioni, alla maggior efficacia biologica, giustificano l’uso di
protoni e degli ioni carbonio nel 12% e nel 3% circa dei trattamenti
oggi somministrati con fasci di raggi X. Gli ioni carbonio presentano
un altro vantaggio che riguarda la durata del trattamento. Un
paziente trattato con protonterapia, così come avviene per i raggi
X, si deve sottoporre a 20-30 sedute, per un totale di 4- 6 settimane
di cura. Nel caso degli ioni carbonio la scarsa riparabilità dei
danni prodotti fa sì che i risultati clinici siano molto simili
anche con schemi di frazionamento diversi tra loro. Il trattamento
può essere concentrato in 8-10 sedute con un notevole risparmio di
stress per il paziente e di costi.
In Italia, la Fondazione TERA, creata
nel 1992 e riconosciuta dal Ministero della Salute nel 1994, si è
posta come scopo principale la realizzazione del “Centro Nazionale
di Adroterapia Oncologica” (CNAO), un centro equipaggiato con
fasci di protoni e di ioni carbonio per il trattamento medico dei
tumori, in particolare dei tumori radioresistenti, e per la ricerca
clinica avanzata.
Dopo molte traversie, il progetto di un
centro per l’adroterapia con ioni carbonio - di 4800 MeV di energia
massima – venne sostenuto dal 2001 dal ministro della salute
Umberto Veronesi e poi da Girolamo Sirchia che, insieme insieme al
Ministro del Tesoro Tremonti, scelse nel 2003 per la costruzione un
terreno situato appena fuori dalle mura del Policlinico San Matteo di
Pavia.
Figura 2

Edifici del Centro Nazionale di Adroterapia Oncologica. (Per gentile concessione della Fondazione CNAO)
In questa fase sono stati estremamente utili, per convincere gli incerti, i primi dati clinici oramai disponibili sui trattamento con ioni carbonio provenenti dall’attività, iniziata nel 1994 in Giappone, dell’HIMAC (Heavy Ion Medical Accelerator Centre, Chiba) dove, alla fine del 2009, sono stati irradiati circa 5500 pazienti. Vanno sottolineati, per esempio, gli ottimi risultati di sopravvivenza a tre anni (più del 70%) dei pazienti portatori di tumori polmonari non a piccole cellule, che fecero comprendere a molti le potenzialità di questa nuova radioterapia dei tumori radioresistenti. Come mostrato nella figura 3, il cuore del CNAO è un sincrotrone di 25 metri di diametro che invia i fasci a tre sale di trattamento, in una delle quali arriva un fascio orizzontale e un fascio verticale. Tutti i fasci sono dotati di sistemi di distribuzione “attiva” della dose. È prevista una seconda fase, nella quale saranno aggiunte due testate rotanti per protoni e ioni carbonio.
Figura 3
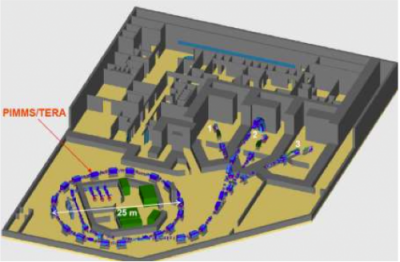
Nello schema del Centro nazionale progettato da TERA si vedono le tre sale di trattamento con i loro quattro fasci, tre orizzontali e uno verticale.
BOX 2 | Gli
acceleratori
Gli acceleratori
utilizzati per produrre i fasci collimati di protoni sono ciclotroni
e sincrotroni. I fasci prodotti da queste macchine hanno proprietà
diverse. Il fascio di un ciclotrone, pulsato a circa 50 MHz, è
sempre presente durante l’irraggiamento ma la sua energia è fissa
ed è quindi necessario muovere meccanicamente degli assorbitori per
ridurne la energia e trattare strati diversi del tumore. Per i protoni si
possono usare sia ciclotroni di 4-5 metri di diametro che sincrotroni
di 7-8 metri di
diametro. Ma l’energia degli ioni carbonio è circa 24 volte
maggiore di quella dei protoni e sono necessari campi magnetici tre
volte più grandi per curvarli. Aumentare il diametro dei ciclotroni
oltre i 5 metri è difficile e la soluzione preferita sinora è
quella di usare sincrotroni con diametri di 20-25 metri. Poiché un
sincrotrone che accelera ioni può anche acceleratore protoni, si
parla spesso di acceleratori duali. La Fondazione
TERA ha progettato un nuovo tipo di acceleratore, il “cyclinac”,
una combinazione tra un ciclotrone e un acceleratore lineare (linac)
per adroni di una ventina di metri. Il cyclinac produce un fascio
pulsato ma sempre presente (come in un ciclotrone) e variabile di
energia in un solo millisecondo (invece del secondo circa di un
sincrotrone). In tutti i centri
di protonterapia del mondo fino al 1997 sono stati usati sistemi
“passivi” relativamente semplici di distribuzione della dose: gli
adroni carichi erano diffusi da due assorbitori e la forma
trasversale del campo di irradiamento era definita per mezzo di
collimatori. Solo nel 1997 presso il PSI (Villigen - Svizzera)
divenne operativa la prima struttura ruotante con un fascio di
protoni da 250 MeV a scansione attiva. Nel sistema
“attivo” del PSI, il bersaglio tumorale viene suddiviso in molte
migliaia di unità elementari dette voxel
e ciascun elemento è irradiato in
passi successivi da un fascio di protoni che ha una sezione di circa
5 mm e un’energia tale di raggiungere la profondità desiderata.
Questa tecnica, detta “spot
scanning”, utilizza appieno le
possibilità offerte da un fascetto di adroni elettricamente carichi,
che depositano il massimo di energia in un piccolo volume localizzato
nel corpo del paziente: è sufficiente variare l’energia delle
particelle per cambiare la profondità a cui si trova il picco di
Bragg e agire sui campi magnetici di due magneti, localizzati qualche
metro prima del paziente, per
muovere trasversalmente il fascetto. Il futuro
dell’adroterapia, sia con protoni che con ioni carbonio, e la
dimostrazione dei suoi vantaggi per i tumori
prossimi a organi critici rispetto ai raggi X, dipende dalla
diffusione di queste tecniche di
distribuzione “attiva” della dose.
Nel 2004 l’Istituto Nazionale di
Fisica Nucleare (INFN) è diventato Partecipante istituzionale della
Fondazione CNAO, assumendo importanti responsabilità nella
realizzazione del Centro. Sandro Rossi, Direttore Tecnico della CNAO,
è stato così affiancato nella direzione da Claudio Sanelli, dei
Laboratori INFN di Frascati. I contributi dell’INFN hanno
riguardato non soltanto la costruzione ma anche la messa in funzione
di tutta le componenti tecniche. Altri Partecipanti della Fondazione
CNAO sono il Comune di Pavia, il Politecnico di Milano, le Università
di Milano e di Pavia, la Fondazione CARIPLO.
Tappe importanti sono state percorse
nel 2009. In luglio sono stati accelerati protoni e ioni carbonio
sino all’energia di iniezione nel sincrotrone (7 MeV/nucleone). Le
correnti misurate sono più elevate di quelle di progetto. In
dicembre le particelle sono state iniettate nel sincrotrone (figura 4).
Figura 4

Panoramica del sincrotrone. Si vedono i magneti deflettori (blu) e la cavità a radiofrequenza (rossa) che accelera le particelle che circolano nell‟anello per un milione di giri in circa un secondo. (Per gentile concessione della Fondazione CNAO)
Si prevede di avere fasci di protoni e ioni carbonio estratti alle energie massime per la primavera del 2010 e di trattare il primo paziente entro lo stesso anno. Se i piani saranno rispettati, il Centro di Pavia entrerà in funzione un anno dopo rispetto al Centro HIT, costruito ad Heidelberg su progetto del laboratorio GSI di Darmstadt e di Siemens Medical. Il CNAO sarà il quarto centro al mondo a trattare pazienti con ioni carbonio, dopo HIMAC e Hyogo in Giappone, e HIT in Germania. Il Direttore medico Roberto Orecchia - che coordina anche il progetto europeo ULICE (Union of Light Ion Centers in Europe) – ha programmato le attività in modo da giungere a regime nel 2014 e irradiare con ioni carbonio circa 2.000 pazienti l’anno. Il CNAO potrà cosi trattare la maggior parte dei pazienti italiani portatori di tumori solidi radioresistenti, nell'ambito del Servizio sanitario nazionale, secondo le tariffe stabilite dal Ministero della Salute. All’inizio si utilizzeranno anche fasci di protoni, ma con il tempo nasceranno in Italia altri centri dedicati alla protonterapia (BOX 3), oltre a quello di Trento, e il CNAO concentrerà le sue attività sempre più sugli irradiamenti con ioni carbonio e altri ioni leggeri, particolarmente efficaci nel controllo dei tumori non radiosensibili. A regime lavoreranno al CNAO circa 150 persone.
BOX 3 | La
terapia a base di protoni
La protonterapia,
proposta nel 1956, per molti decenni si è sviluppata lentamente
poiché venivano
utilizzati, per lo più in modo parassitario, acceleratori costruiti
per la ricerca nucleare. Dalle
esperienze iniziali si è sviluppato un robusto filone di terapia con
protoni dei melanomi oculari,
tumori poco profondi e piccoli che richiedono protoni di 65 MeV, corrispondente a
4 cm di penetrazione nei tessuti molli. Più di circa 15.000 pazienti
sono stati trattati nel
mondo con ottimi risultati. In Italia nei Laboratori Nazionali del
Sud dell’INFN è stato creato,
usando un ciclotrone superconduttore dedicato alla fisica nucleare,
un centro di protonterapia di
questo tipo. Altri centri europei per melanomi oculari si trovano in
Svizzera, Francia, Gran
Bretagna e Germania. Molto più lento
è stato lo sviluppo clinico della terapia dei tumori profondi, che
richiedonoFermilab
fu costruito un sincrotrone di sette metri di diametro da installare
come cuore del primo centro ospedaliero presso il Loma
Linda University
Medical Centre (California). Il
primo paziente fu trattato nel 1992 e oggi nelle sale dotate di
testate rotanti di 10 metri di diametro sono tenute più di ventimila
sessioni di irradiamento all’anno trattati per il trattamento di
più di 1000 pazienti. Oggi cinque ditte
offrono centri di protonterapia chiavi in mano e ogni anno ne entrano
in funzione tre o quattro. All’inizio del 2010 vi sono nel modo una
trentina di centri di protonterapia o
in funzione o in costruzione. In Italia la Provincia di Trento ha
costituito un’apposita
Agenzia (ATREP) che è stata finanziata per realizzare un centro di
protonterapia con due testate
rotanti. Studi
condotti in Austria, Francia, Italia, Germania e Svezia concordano
sul fatto che, nel medio termine, il 12% circa dei pazienti oggi
irradiati con le tecniche moderne di raggi X si avvantaggerebbero da
un trattamento con fasci di protoni.
protoni di almeno
160 MeV. Pur praticati sin dagli anni ’50 in laboratori di fisica,
solo dagli inizi degli anni ’90 sono diventati una pratica clinica.
Soltanto alla fine degli anni ‘80 a Fermilab
fu costruito un sincrotrone di sette metri di diametro da installare
come cuore del primo centro ospedaliero presso il Loma
Linda University
Medical Centre (California). Il
primo paziente fu trattato nel 1992 e oggi nelle sale dotate di
testate rotanti di 10 metri di diametro sono tenute più di ventimila
sessioni di irradiamento all’anno trattati per il trattamento di
più di 1000 pazienti. Oggi cinque ditte
offrono centri di protonterapia chiavi in mano e ogni anno ne entrano
in funzione tre o quattro. All’inizio del 2010 vi sono nel modo una
trentina di centri di protonterapia o
in funzione o in costruzione. In Italia la Provincia di Trento ha
costituito un’apposita
Agenzia (ATREP) che è stata finanziata per realizzare un centro di
protonterapia con due testate
rotanti. Studi
condotti in Austria, Francia, Italia, Germania e Svezia concordano
sul fatto che, nel medio termine, il 12% circa dei pazienti oggi
irradiati con le tecniche moderne di raggi X si avvantaggerebbero da
un trattamento con fasci di protoni.
Questo articolo ha scopo puramente divulgativo e gli autori non possono fornire in alcun modo consulenze o pareri su situazioni personali: nel caso invitiamo i lettori a rivolgersi al proprio medico di famiglia.
Attualmente solo il Centro oculistico di Catania è attivo.
Il CNAO comincerà a trattare i pazienti nel 2011. Per maggiori informazioni
riguardo alla possibilità di sottoporsi della terapia e ai contatti per
ottenere un consulto, riportiamo i collegamenti che seguono:
- Sito del Ministero della Salute, L'Adroterapia
- Fondazione CNAO
(Centro Nazionale di Adroterapia Oncologica), Pavia (http://www.cnao.it/). Per qualunque informazione è attivo il servizio medico al
quale afferiscono più specialisti che rispondono a domande relative alle
indicazioni cliniche per questo tipo di trattamento innovativo: nel più breve tempo possibile, e compatibilmente con la quantità di quesiti pervenuti, sarà fornita una risposta via e-mail ([email protected]).
- Centro di
Adroterapia e Applicazioni Nucleari Avanzate, specializzazione nel trattamento
dei tumori oculari, Catania (sito)
Azienda
Ospedaliero-Universitaria Policlinico di Catania, Via
Santa Sofia 78, 95123 – Catania
Struttura Complessa di Radiodiagnostica e
Radioterapia
Direttore:
Prof. Giovanni Carlo Ettorre
Referenti: Prof. Giuseppe Privitera,
Dott. Corrado Spatola, Dott. Luigi Raffaele
Tel: +39 0953782849 | +39 0953782846 | +39 0953782381 | +39 0953781296
Fax: +39 0953782360
Clinica Oculistica
Direttore: Prof. Alfredo Reibaldi
Referente: Dott. Johannes Ott
Tel: +39 0953781291
Fax: +39 0953781288
mail: [email protected]

