Spesso nell’ambito della sintesi, molte reazioni prendono un corso totalmente inaspettato rispetto a quanto precedentemente pianificato nella nostra mente. Questa situazione accumuna certamente molte discipline chimiche ma nella chimica dei cluster spesso raggiunge livelli di frustrazione imparagonabili. Non è raro che a ciò possa aggiungersi la beffa nel constatare che il prodotto isolato manifesti proprietà più interessanti di quello immaginato.
È altresì vero
comunque che queste difficoltà e incomprensioni hanno contribuito in maniera
non secondaria a rendere ancor più affascinante questa chimica dimostrando come
il reale progresso della scienza spesso sia frutto di scoperte casuali
che in un primo momento sarebbero state difficili o persino impossibili da
concepire. A tal riguardo la recente sintesi del cluster [Tl2Pd14(CO)9(PMe3)11]-,
precedentemente formulato come Au2Pd14 [1] costituisce
un esempio calzante di come anche le reazioni più semplici possano divenire
un’avventura nel mondo dell’ignoto scientifico. Tale cluster fu originalmente
sintetizzato dalla reazione di Pd8(CO)8(PMe3)7
e AuCl(PCy3) in presenza di TlPF6 come “presumed innocent
chloride abstractor” nel tentativo di ottenere un cluster bimetallico di Au-Pd.
La natura bimetallica del composto fu stabilità solo sulla base dell’analisi di
diffrazione a raggi x su cristallo singolo mediante la quale Tl (n.a. 81) e Au (n.a. 79) sono indistinguibili a causa
dei loro fattori di scattering simili. Recentemente, l’isolamento del medesimo
composto a partire da una differente via di sintesi, che non si avvale
dell’utilizzo di sali di oro, ha dimostrato l’errata formulazione
precedentemente riportata. [2]
Questa difficoltà nel progettare in maniera razionale sintesi
di nuovi cluster carbonilici contribuì ad una accezione negativa di questa
chimica come evidenziato da F.A. Cotton: [3] “Non sembra esserci per il momento nessun indizio per cui
una certa sintesi (o serie di sintesi) venga deliberatamente impiegata per
ottenere un particolare cluster carbonilico ad alta nuclearità partendo da
complessi mononucleari. Al contrario, tutti i cluster sono stati preparati per
caso o scoperti involontariamente. Cosi lo studioso della chimica dei cluster è
un po’ nella posizione di un collezionista di lepidotteri e meteoriti, che gira
attentamente per la campagna e fa esclamazioni di piacere, quando è abbastanza
fortunato di incontrare una nuova specie”.
A partire dagli anni ’60 il crescente
numero di cluster ottenuti da reazioni spesso difficilmente riproducibili indussero
ad una generale disaffezione riducendo il valore di questi oggetti molecolari a
delle semplici curiosità scientifiche.
Da qui, in particolare, crebbe l’interesse
di Paolo Chini (1928-1980) e Lord J. Lewis (1928-2014) volto alla
razionalizzazione di vie sintetiche più selettive nel tentativo di isolare
nuovi cluster ad elevata nuclearità. [4] A tal riguardo, la messa a
punto e la chiara comprensione di innovative strategie di sintesi quali la condensazione redox e la degradazione termica sono senza alcun
dubbio i contributi più grandi apportati dalla “scuola di Milano”.
Con il passare degli anni la caratterizzazione di un crescente
numero di composti a cluster ha contribuito ad una visione più chiara e
generale riguardo la loro sintesi. Questo importante traguardo è stato
raggiunto in maniera “silenziosa” ed è per questo che in parte si è rimasti ad
un’immagine di una chimica che non esiste più. In particolare, negli anni ‘90
si è registrato un nuovo interesse nello studio dei cluster principalmente
grazie alla sviluppo tecnologico dei diffrattometri: l’utilizzo del rivelatore bidimensionale
ha permesso di ridurre drasticamente i tempi di raccolta da sempre il
principale limite di questa chimica.
Ad oggi, le difficoltà della chimica dei cluster non sono tanto legate a come ma a cosa si vuole sintetizzare. Come è possibile pianificare la sintesi di un composto se non se ne conosce la natura? La descrizione offerta da Cotton per quanto suggestiva è incompleta. Le sintesi dei cluster avvenute in maniera fortunosa spesso vengono successivamente sostituite da altre più razionali che permettono di raggiungere elevate rese.
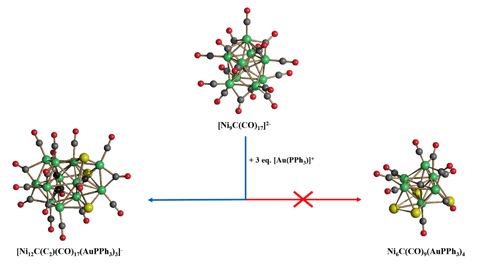
Scoperta casuale del [Ni12C(C2)(CO)17(AuPPh3)3]-. Il leganti PPh3 non sono rappresentati allo scopo di rendere più chiara la disposizione degli atomi all’interno della gabbia metallica (nichel, verde; oro, giallo, carbonio, grigio; ossigeno, rosso).
Un esempio rappresentativo è dato dalla casualità con cui è stata isolata la specie [Ni12C(C2)(CO)17(AuPPh3)3]- la cui iniziale scoperta avvenne per errore di sintesi nel tentativo di ottimizzare la reazione di formazione del Ni6C(CO)9(AuPPh3)4. La reazione così condotta, a causa delle basse rese, non avrebbe permesso una completa caratterizzazione chimica del composto. Successivamente questa via di sintesi è stata sostituita da una nuova sulla base di evidenze strutturali. [5] Infatti la gabbia metallica è costituita da un frammento di Ni10C2 reminiscente a quello del cluster [Ni10C2(CO)16]2- già noto in letteratura. Sulla base di questa osservazione è stato possibile ottimizzare la reazione utilizzando una miscela di [Ni10C2(CO)16]2-, [Ni9C(CO)17]2- e [Au(PPh3)]+ in rapporto 1:1:3.
Un chimico che intende sintetizzare un nuovo cluster è quindi nella stessa situazione di un architetto che progetta un edificio non essendo però a conoscenza del numero e del tipo di mattoni a sua disposizione. Gli ostacoli nella sintesi risiedono nella predizione dell’esistenza o stabilità del target la cui reazione di formazione spesso viene proposta o riproposta sulla base di analogie di struttura o di reattività chimica di altri cluster riportati nella letteratura scientifica.
di IACOPO CIABATTI
Bibliografia
[1] Copley R.C.B., Hill
C.M., Mingos D.M.P. J. Cluster Sci. 1995, 6, 71-91.
[2] Mednikov E.G., Dahl L.F. Chem. Commun. 2013, 49, 1085-1087.
[3] Cotton
F.A. Q. Rev. Chem. Soc. 1966,
20, 389-401.
[4]
Chini P. J. Organomet. Chem. 1980, 200, 37-61.
[5]
Bortoluzzi M., Ciabatti I., Femoni C., Hayatifar M., Iapalucci M.C., Longoni G., Zacchini S. Dalton
Trans. 2014, 13471-1347

