Uno studio su Nature indaga le primissime fasi dello sviluppo del tumore del pancreas, cercando d'identificare alterazioni molecolari precoci che indichino l'inizio della progressione tumorale. I risultati evidenziano mutazioni nel gene KRAS e che ogni precursore è un evento indipendente dagli altri: non sono futuri tumori, ma popolazioni che potrebbero in effetti darvi origine.
Crediti immagine: Wikimedia Commons. Licenza: CC attribution-sharealike 3.0 unported
Dei meccanismi mediante i quali una cellula normale cambia il suo status e prende la via della trasformazione tumorale sappiamo molto: mutazioni in geni coinvolti nel controllo del ciclo cellulare, della proliferazione, nella rimozione di basi danneggiate o inserite in modo scorretto dal DNA, mutazioni che rendono questi geni non funzionali o troppo funzionali. Sappiamo molto anche di tutti gli eventi che consentono a un tumore di crescere, invadere, infiltrare, collegarsi al circolo ematico, diventare resistente alle terapie, disperdere metastasi.
Ma delle primissime fasi, di quelle in cui in un tessuto sano sta succedendo qualcosa di anomalo, una cellula non si limita a replicare se stessa ma diventa un gruppo di cellule che però è ancora molto lontano dall'essere definito un tumore, di quello sappiamo di meno. Perché non lo vediamo. Sappiamo riprodurlo in colture cellulari, sappiamo indurlo in modelli animali. Ma sono tutte situazioni determinate in modo sperimentale: in pratica, ci attendiamo che ciò avvenga trattando chimicamente e modificando geneticamente. Invece, quello che succede in modo spontaneo nel nostro organismo, mentre noi viviamo inconsapevoli la nostra vita, non lo vediamo fino al giorno in cui la comparsa di sintomi, oppure un controllo, ci dicono che qualcosa è successo, perché vediamo il tumore che è diventato.
Ma quanto sono frequenti i tentativi di una cellula di sovvertire l'ordine costituito di un tessuto e iniziare a replicarsi in modo non controllato? Quali sono i primissimi cambiamenti che le consentono di farlo? Quante probabilità hanno queste iniziative di andare avanti? Regrediscono spontaneamente, oppure dando loro il tempo necessario andranno avanti? Possiamo dire che un tumore non è questione di se ma di quando? È possibile individuare le cellule alterate prima che sia tardi, considerando che in fasi così precoci si tratta di lesioni microscopiche che sfuggono alla diagnostica normale? Ma poi, se fosse possibile, sarebbe utile individuarle?
Si sa che il tumore più lo scopri in fase precoce meglio è. Su quel punto iniziale di un tumore, ammesso poi che sia possibile identificarlo, trattandosi di un percorso progressivo, ci sono tante domande. Un articolo pubblicato recentemente su Nature si avvicina a darci qualche risposta, da prendere con la consapevolezza che sono risposte che valgono per il modello descritto, il pancreas: in un organo o tessuto diverso la situazione potrebbe essere molto diversa. E da prendere con la consapevolezza che non siamo al T con zero (il vero e proprio momento iniziale in cui inizia lo sviluppo del tumore), ma ancora molte cellule dopo. D'altronde, forse il T con zero vero e proprio non è uno stato definito, forse non si distinguerebbe dal rumore di fondo della normale variabilità all’interno di un tessuto.
Del resto, anche senza cercare risposte universali, studiare come nasce un tumore del pancreas è di grande interesse. L'adenocarcinoma duttale pancreatico (PDAC, il tumore più frequente del pancreas che origina dalle cellule dei dotti pancreatici) non è un tumore molto frequente, ma l'incidenza è in aumento. Inoltre, la prognosi è particolarmente severa, con una sopravvivenza a cinque anni recentemente salita al 12%, perché rimane asintomatico, nascosto fino al momento in cui ormai è tardi. In circa il 50% dei casi alla diagnosi è già metastatico; risponde poco alle terapie convenzionali e l’approccio chirurgico non è dei più semplici.
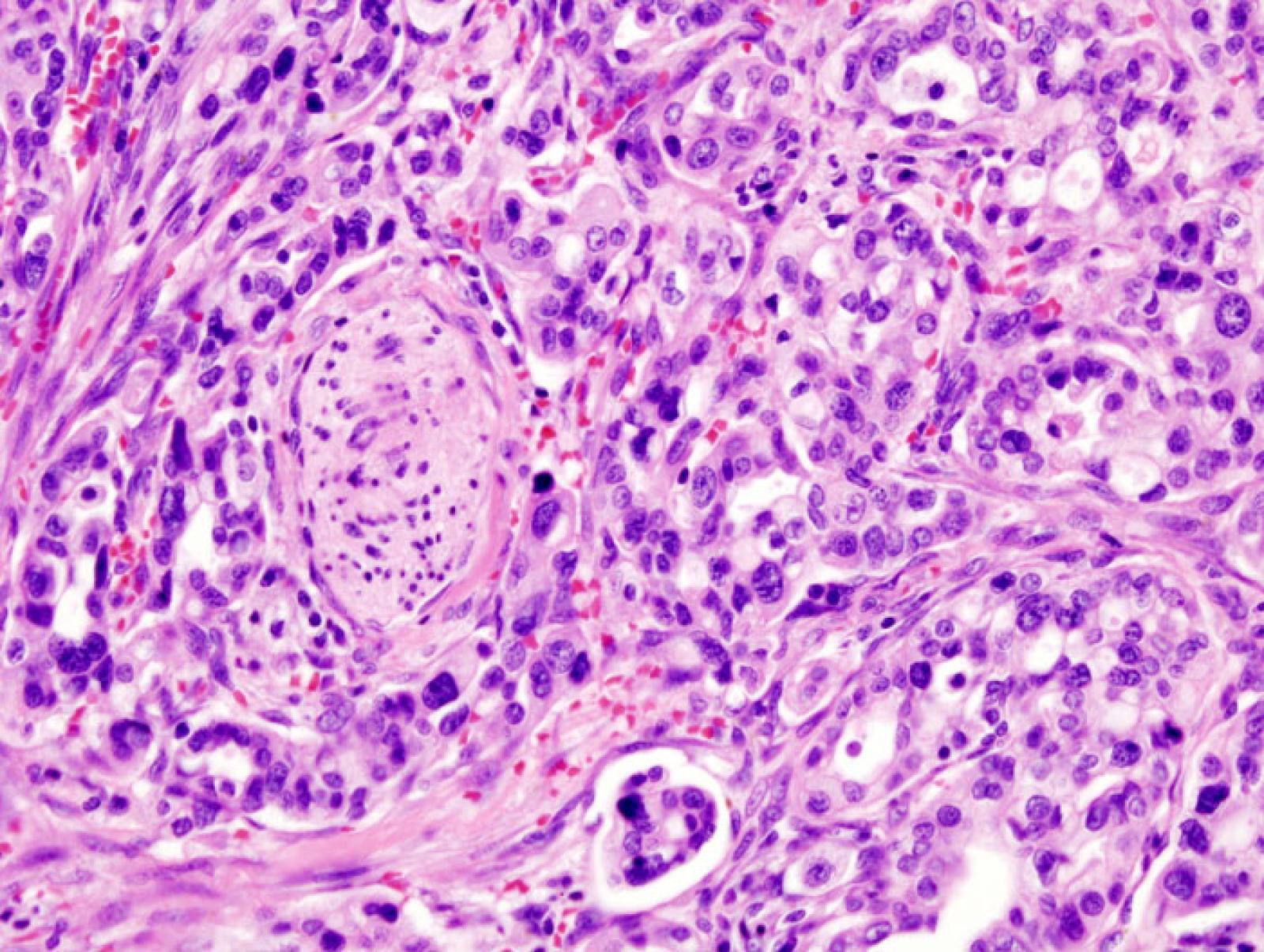
In pratica, gli autori dello studio (lo raccontiamo in modo molto sintetico, ma è veramente una quantità enorme di lavoro che hanno fatto) partono da 38 campioni di tessuto sano del pancreas (immaginiamo dei cubetti dal volume che va da 1 a 3.5 cm cubi) di altrettanti pazienti cui l'organo è stato rimosso con intervento chirurgico. Mediamente per la presenza di un tumore (solo in alcun casi un PDAC), e questa è probabilmente la criticità maggiore del lavoro: sarebbe stato molto meglio fare quelle analisi su campioni di donatori non pazienti oncologici ma perché deceduti per altro motivo, come incidente stradale, arresto cardiaco... Ma da un lato è comprensibile sia più semplice ottenere campioni da un post-operatorio invece che post mortem. Dall'altro, vedremo che alla fine la cosa non sembra essere rilevante per lo studio.
I campioni sono stati sezionati (ottenendo centinaia di sezioni per ogni campione), e ogni sezione è stata preparata per un analisi bidimesionale dei tipi cellulari presenti, come fosse un vetrino di microscopio. Poi, con un sistema basato su IA già descritto in una pubblicazione precedente, integrando le informazioni delle singole sezioni piane, hanno ricostruito la struttura in 3D di ogni campione, con definizione alla singola cellula.
Il gruppo di ricerca ha così osservato che in ogni campione di tessuto sano di pancreas erano presenti diversi gruppi di cellule che sono a tutti gli effetti dei precursori di un tumore (PANcreatic Intraepithelial Neoplasia, PanIN, ma per semplicità li chiameremo precursori) a carico delle cellule duttali. In pratica, una descrizione dettagliata dal punto di vista morfologico degli istanti iniziali di quelli che potrebbero un giorno diventare degli adenocarcinomi duttali.
L'aspetto più sorprendente però è il numero di questi precursori: in 38 campioni sono stati trovati 889 precursori, con una media di 21 precursori per campione (e un range da 4 a 92). Qualche dato: la maggior parte di questi precursori aveva una dimensione inferiore a 0,5 cm, l'86% conteneva meno di 100.000 cellule, il 30% conteneva meno di 1000 cellule. Entità microscopiche.
Estrapolando i dati al volume medio di un pancreas sano, e considerando la variabilità tra i diversi campioni, gli autori ipotizzano che in un pancreas potrebbero esserci da 130 a 2500 precursori.
L'aspetto più interessante, però (almeno per chi si interessa di come si forma un tumore), è sapere cosa succede dentro quelle cellule, e questo ce lo dice la genomica. Qui diventa un pochino più complicato. Per 37 precursori, alcune sezioni non sono state utilizzate per ricostruire la struttura in 3D ma ne è stato invece isolato il DNA, sottoposto a sequenziamento dell'esoma, ovvero solo delle regioni codificanti del genoma. Questo ha limitato la quantità di DNA da sequenziare e ha consentito di abbinare un'analisi genomica "profonda" (ogni base è stata letta più di 200 volte) a quella morfologica dei campioni. Dal sequenziamento dell'esoma è emerso che 36 dei 37 precursori avevano già mutazioni nel gene KRAS.
Apriamo una piccola parentesi. KRAS è una piccola proteina che promuove normalmente la replicazione cellulare, ma alcune mutazioni nella sua sequenza ne alterano la struttura e rendono la sua attività non più controllabile. Per questo le mutazioni in KRAS sono frequenti in moltissimi tumori, ma in alcuni in particolare (e quello del pancreas è fra questi), sono sempre driver, ovvero sono quelle che fin dall'inizio "spingono" la trasformazione tumorale. Altre mutazioni si aggiungeranno in seguito e amplieranno le potenzialità del tumore.
Questo studio conferma che mutazioni in KRAS sono presenti fin dall'inizio. E quelle trovate sono esattamente le stesse che poi si trovano nei tumori veri e propri (per chi è interessato, in 31 dei campioni le mutazioni in KRAS erano a carico del codone 12 (G12X), negli altri erano Q61H). Nel 54% dei campioni sono state trovate solo mutazioni in KRAS, negli altri anche in altri geni.
Tutto questo porta a ipotizzare che in un pancreas sano ci siano centinaia di potenziali tumori allo stato di precursore, che hanno già almeno una mutazione necessaria ad andare avanti. Il che è molto interessante, o molto inquietante, dipende dal punto di visto.
Ma lo studio ci dice anche altro. Ci dice, cioè, che precursori distanti anche pochi millimetri possono avere mutazioni in KRAS diverse, oppure condividono tra di loro la mutazione in KRAS ma non le altre mutazioni. Tradotto, significa che ogni precursore è un evento casuale e indipendente dagli altri. Ed anche dall'eventuale tumore che ha causato l'intervento chirurgico. Le mutazioni condivise come in questo caso sono un caso emblematico di convergenza adattativa: si trovano sempre quelle perché sono quelle più utili a un tumore, e sono quelle che vengono selezionate. Altre mutazioni potrebbero anche insorgere, ma non le troveremmo in un tumore perché non danno alcun vantaggio alla cellula che porta la mutazione.
Un dato aggiuntivo molto interessante è che in alcuni casi (pochi) all'interno dello stesso precursore si trovano cellule con mutazioni in KRAS diverse. Siccome non possono coesistere mutazioni diverse nello stesso gene nella stessa cellula, questo significa che quei precursori non derivano da un singolo evento iniziale, da una singola cellula, ma da più eventi indipendenti. Si definiscono policlonali. Questo però è in contrasto con la teoria clonale del cancro, per la quale ogni tumore deriva da una singola cellula (tutte le cellule del tumore condivideranno lo stesso "pacchetto" di mutazioni iniziali, alle quali poi se ne aggiungeranno altre nel corso della progressione), ed è anche in contrasto con l'evidenza che i PDAC sono dei tumori clonali, nei quali tutte le cellule condividono le stesse mutazioni precoci.
Quello che questo studio ci dice quindi è che questi precursori in effetti non sono ancora dei futuri tumori, almeno non tutti, ma delle popolazioni di cellule già "iniziate" all'interno delle quali si potrà, forse, selezionare un clone che poi darà origine a un tumore clonale.
Questi i dati principali con cui andiamo alle conclusioni (leggendo l’articolo ci sono molte più informazioni, ma qui non avrebbero posto). La prima conclusione è che non sappiamo se il quadro descritto in questo articolo sia comune ad altri tessuti e organi o sia esclusivo per il pancreas. La seconda conclusione è che, visto il numero molto elevato di precursori in un tessuto considerato sano e l'incidenza invece relativamente bassa del tumore del pancreas, dobbiamo pensare che non sia così probabile che quei precursori vadano avanti a diventare tumori. Infatti, per quanto sia inquietante sapere che ci sono e che sono tanti, prima di leggere questo articolo mediamente abbiamo sempre vissuto e viviamo tuttora la nostra vita senza essere nemmeno consapevoli della loro esistenza. Non sappiamo questi precursori quanto siano stabili, quanto siano rapidi nel formarsi e nel regredire (se lo fanno), perché quella che ci mostra questo studio è una foto istantanea, congela un momento della nostra vita (e del nostro pancreas) e non è possibile seguirli nel tempo per sapere se regrediscono spontaneamente e se ne formano altri. Ma sarebbe un aspetto importante, perché si sta puntando molto su analisi diagnostiche sempre più precoci, che arrivino a vedere biomarcatori anche anni prima dell'insorgenza del tumore.
Dovremmo chiederci quanto sarebbe effettivamente utile riuscire a individuare questi precursori (ammesso che sia possibile) visto che poi difficilmente andranno avanti. Rischieremmo l’overdiagnosi? È meglio puntare su metodi di indagine meno precoci?
D'altro canto, però, noi non sappiamo cosa sia necessario perché da uno di questi precursori si origini un tumore, quando succede. E sappiamo che succede. Non sappiamo se uno tra mille di quei precursori scoperti in un pancreas considerato sano potrà andare avanti a causa di un fattore ambientale a cui siamo esposti (alimentazione, fumo, esposizione professionale o cronica a sostanze chimiche...) su cui quindi sarebbe stato importante lavorare (punto determinante, un conto è la suscettibilità a un cancerogeno di un tessuto sano, un conto quella di un tessuto in cui le cellule hanno già una o più mutazioni critiche e hanno già fatto il primo passo verso la trasformazione) e se il rischio che questo accada sia collegato all'aumento dell'incidenza di PDAC osservato negli ultimi due decenni (e previsto per i prossimi decenni) o se invece sia solo questione di un lancio di dadi.

