
Sono passati 18 anni da quando si è parlato per la prima volta di "chimica in flusso" e di microreattore. È giunto il momento di celebrarne il successo.
La pandemia ha dato una straordinaria accelerazione alla ricerca di nuovi farmaci e vaccini. Ma, una volta scoperti, si porrà il gigantesco problema di produrli rapidamente, ancora meglio se in stabilimenti localizzati un po' ovunque in modo da evitare accaparramenti di farmaci salva vita a beneficio solo di alcuni paesi. C'è un modo per imprimere questa accelerazione alla produzione di farmaci in impianti di piccola-media grandezza, che siano al contempo sicuri e sostenibili dal punto di vista ambientale? La risposta c'è e si chiama “chimica in flusso”.
Nell’estate del 2002 venne pubblicato per la prima volta un articolo scientifico contenente nel titolo questa espressione. Sono passati 18 anni ed è forse giunto il momento di guardare indietro e celebrare il successo della chimica in flusso, che oggi si fa sempre più strada nell’industria moderna.
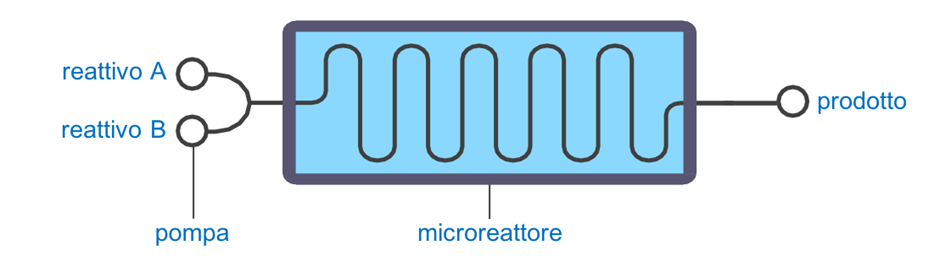
Figura 1 Immagine schematica di un processo di chimica in flusso.
Nella chimica in flusso, due o più reattivi vengono pompati in un capillare di dimensioni piccolissime (Figura 1). Qui, in questo microreattore, si verifica la reazione chimica e il prodotto finale viene raccolto all’uscita, in una sorta di flusso continuo dove i reagenti entrano nel capillare, si combinano tra di loro, e formano prodotti che lasciano la camera di reazione. Questo tipo di chimica “continua” viene utilizzata da decenni nell’industria petrolifera, ma solo di recente è entrata nel farmaceutico e nell’industria della chimica fine. Settori, quest’ultimi, che sono stati storicamente sospettati di generare alte quantità di rifiuti sotto forma di solventi organici.
Poiché la reazione chimica non avviene in un reattore tradizionale (che assomiglia solitamente a un pallone), ma all’interno di un microreattore di dimensioni ridotte, è possibile controllare in maniera più accurata quei parametri chiave di reazione, come la temperatura, la pressione e il grado di miscelazione dei diversi reattivi. Si hanno così reazioni più veloci e anche più selettive, con una riduzione notevole degli sprechi e dell’impatto ambientale del processo farmaceutico. Non a caso, la Food and Drug Administration, l’agenzia americana che vigila sulla regolamentazione e sull’approvazione di tutti i prodotti alimentari e farmaceutici, consiglia oggi l’uso della chimica in flusso per la produzione di farmaci, proprio perché questa tecnologia può contribuire in modo significativo al raggiungimento dell’obiettivo di “zero rifiuti” previsto dalle Nazioni Unite.
Un altro importante vantaggio della chimica in flusso è l’intrinseca sicurezza dei processi, anche quando si maneggiano sostanze altamente pericolose. Infatti, il volume di reazione è ridotto al minimo grazie alle microdimensioni del reattore; solo una piccola quantità di materiale potenzialmente pericoloso viene riscaldata e trasformata in prodotto. Per fare un esempio, se 10 litri di un reattore tradizionale con all’interno un composto altamente energetico esplodessero, potrebbero esserci danni seri e potenzialmente fatali. Se invece si spingono gli stessi 10 litri attraverso un microreattore di 1 millilitro di volume, solo 1 millilitro di miscela reagisce in ogni istante. Per cui, se dovesse verificarsi un’esplosione, il rischio sarebbe pari ad 1/1000 rispetto a quello della sintesi tradizionale.
I metodi di chimica in flusso sono poi facilmente scalabili. Spesso, infatti, il passaggio delle sintesi dal laboratorio alla produzione può essere difficoltoso e si possono avere reazioni incontrollate. Con una sintesi in flusso, lo scale up è immediato perché semplicemente si fa andare avanti la reazione per più tempo, in modo da produrre un quantitativo maggiore di prodotto. Questo permette di risparmiare tempo e denaro.

Figura 2 Confronto dello spazio impiegato per un processo con chimica tradizionale (A) e un processo di chimica in flusso (B).
Su scala industriale, rimane infine una certa tendenza a preferire la chimica in flusso anche per la natura miniaturizzata di questi reattori rispetto a quelli tradizionali. Ciò sembra cambiare la prospettiva dei produttori farmaceutici, che non hanno più bisogno di costruire grandi impianti per ospitare produzioni batch (Figura 2). Questa riduzione dello spazio di produzione consente non solo di ridurre i costi, ma anche di avere sistemi compatti che possano rispondere più prontamente alle esigenze di mercato. E, nell’era delle pandemie, questo aspetto è fondamentale. Fare affidamento su una produzione locale, usando reattori efficienti, piccoli e sicuri, può essere infatti una scelta saggia se non si vuole dipendere soltanto sul commercio internazionale.
In conclusione, grazie alla maggiore qualità dei prodotti, alla sicurezza dei processi e alla flessibilità di produzione, la “chimica in flusso” sta conquistando l’industria farmaceutica. Un’industria che cerca quindi di rispondere alle istanze della società, divenendo più verde, pulita, circolare e moderna.

