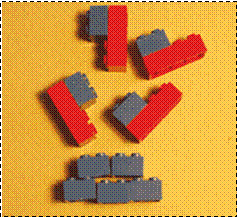Le esperienze proposte
Questa sezione contiene le descrizioni di alcune esperienze proposte dai tutor riguardanti i concetti presentati nel percorso descritto per le varie classi della scuola elementare.
L’obiettivo è di fornire una documentazione descrittiva e visiva degli “oggetti didattici” previsti dal progetto.
Le esperienze descritte hanno alcune caratteristiche comuni: uso di materiali poveri e di facile reperibilità, individuazione dei concetti scientifici o pro-scientifici su cui lavorare, documentazione visiva (fotografie, video, disegni).
- 17231 letture
Bolla sospesa
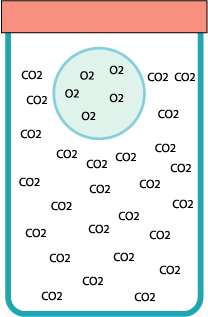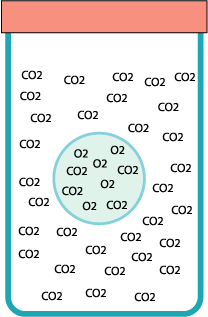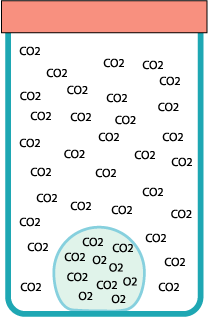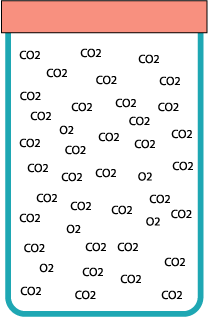
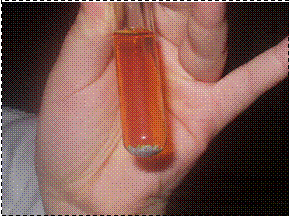
Una bolla di sapone può “galleggiare” immobile all’interno di un barattolo, grazie a un trucco: il barattolo è pieno di anidride carbonica.
Si può decidere dall’inizio se portare un barattolo già pieno di anidride carbonica e ben sigillato (magic science) o se mostrare tutta la preparazione. Con i bambini della classe quinta di Sambucheto, nella primavera 2003, abbiamo optato per la seconda soluzione. Alla fine essi stessi hanno spiegato tutti i fenomeni osservati e ripetuto l’esperimento da soli per mostrarlo alle altre classi.

Predisporre i materiali come nella foto. Meglio mettere all’inizio un’abbondante riserva di bicarbonato. Da notare che nel tubo di gomma ci sono due batuffoli di ovatta infilati alle estremità, per evitare che l’areosol (che si forma quando si mette l’aceto sul bicarbonato) entri appannando e bagnando il fondo del barattolo. Per evitare che a causa delle correnti d’aria l’anidride carbonica esca dal barattolo conviene chiuderlo con un cartoncino forato per far passare il tubo o con lo stesso tappo a vite spostato leggermente (infatti l’anidride carbonica tende a rimanere in basso, come se fosse un liquido, anche se il tappo è aperto).

L’aceto va versato poco per volta, senza agitare. Quindi si preme il tubo nel collo dell’imbuto e si agita gradualmente, in modo da controllare la schiuma ed evitare che vada a finire nel tubo. Il gas attraverserà l’ovatta ed entrerà nel barattolo, stratificandosi dal basso e scacciando l’aria dalla sommità.
Dopo 4 o 5 immissioni (si tenga presente che ogni decilitro di aceto origina circa un litro di anidride carbonica, considerate le perdite, e consuma 4 g di bicarbonato) si può iniziare a vedere se il barattolo è pieno, infilando dall’alto un fiammifero acceso.


Se questo si spegne all’istante vuol dire che il barattolo è pieno e lo si può chiudere. Ovviamente disponendo di una bombola di anidride carbonica compressa o di un estintore aperto ad anidride carbonica, l’operazione di riempimento sarebbe molto più agevole.


Per preparare la saponata per le bolle, sciogliere un cucchiaio di zucchero in 4 cucchiai di acqua distillata calda, aggiungere a caldo un volume uguale di detersivo liquido per piatti e agitare a lungo con il cucchiaio. Chiudere in un barattolino per l’uso successivo.
Con una cannuccia provare a formare le bolle di 6-8 cm di diametro e a staccarle, operazione che dovrà essere effettuata sull’imboccatura del barattolo una volta aperto. Aprire il barattolo svitando il coperchio e facendolo poi scorrere orizzontalmente e lentamente, per evitare rimescolamenti eccessivi con l'aria soprastante..
 .
.
Il metodo migliore è di soffiare le bolle con la cannuccia immersa nel barattolo. Quando saranno abbastanza grandi saliranno da sole ancor prima di staccarsi dalla cannuccia. Se si staccano bolle troppo piccole queste cadranno sul fondo.


Se il barattolo è ben pieno di gas la bolla galleggerà in cima alla sua superficie. Appena scende un po’ al disotto dell’orlo si può chiuderla nel barattolo. La bolla è intrappolata!


La bolla contiene aria, un gas più leggero dell’anidride carbonica*.
Stranamente la bolla non è immobile: nei tempi lunghi si nota che tende a scendere. Questo fatto si spiega con il modello particellare e sapendo che l’anidride carbonica si scioglie in acqua.
Le sue particelle si sciolgono prima nella pellicola liquida della bolla e da qui rievaporano anche all’interno. Il risultato è che, a poco a poco, la bolla si riempe di anidride e diventa sempre più pesante. L’aria invece non si scioglie molto nell’acqua e non riesce a uscire dalla bolla… finché…
Ci sono dei giochi che consentono di creare bolle colorate con sottilissimi film di plastica. Magari in questo modo si possono creare delle bolle che galleggiano per sempre! Chi ci prova?
* Nota dell'autore: Alcuni bambini hanno detto che sapevano la formula dell’anidride carbonica (CO2) e che nell’aria c’era ossigeno. Perciò, hanno detto, “per forza l’anidride carbonica ha particelle più pesanti dell’aria (CO2>O2)”. Da quel momento ho smesso di fare acrobazie per semplificare la spiegazione. Ma non è detto che vada sempre così bene. Una cosa è non spiegare la chimica alle elementari, un’altra è darsi la zappa sui piedi e decidere di non utilizzare vantaggiosamente i concetti che i bambini hanno acquisito da altre “agenzie formative”, soprattutto i genitori. Anzi, a scuola tutte le esperienze dei bambini andrebbero catturate sistematicamente, socializzate e capitalizzate in modo ordinato.
Questa esperienza è stata ideata e descritta da Alfredo Tifi
- 17880 letture
Conducibilità termica dei metalli
Si dice spesso che i materiali metallici sono conduttori di calore.
Questo esperimento mette in evidenza che i “buoni conduttori” di calore non sono, in realtà, tutti ugualmente “buoni”. Insomma abbiamo a che fare con una proprietà che varia, e non poco, a seconda del metallo.
Guarda il video dell'esperimento
La tabella riporta i valori della conducibilità termica di diversi metalli.
|
Metallo Conducibilità/W/(cm·°C) |
 |
I dati qui raccolti sono in sintonia con i risultati dell’esperimento, in quanto l’acciaio ha minore conducibilità e l’alluminio è un miglior conduttore rispetto all'ottone e all’acciaio. Il rame è nettamente superiore anche all’alluminio nel trasporto di calore e nell’esperimento con una barra di rame si dovrebbe vedere la differenza.
Il materiale con la maggiore conducibilità termica è il diamante: il suo valore di conducibilità può andare da 9 a 26 delle unità in tabella, cosa che lo rende estremamente freddo al tocco. Tra i metalli, la lega al 72% di argento e il 28% di rame (CuSil) conduce meglio il calore rispetto al solo argento.
Le seguenti immagini sono tratte dal sito www.hometrainingtools.com
Le quattro barrette oblique sono di ottone, rame, alluminio e acciaio. Alle estremità ci sono dei piccoli fori su cui far aderire le gocce di cera fusa.





Si pongono 4 gocce uguali di acqua colorata a distanze regolari e una quinta all’estremità delle barrette. Si accende il fornellino, che in pochi minuti supera la temperatura di 200 °C. Le gocce bolliranno quando la temperatura supererà i 100 gradi a causa della trasmissione del calore. Può essere opportuno mettere le gocce più distanti solo dopo che le vicine siano evaporate.
Questi i risultati del nostro esperimento:
12:09 - accensione
12:12 - 1ª bolla alluminio (Al)
12:13 - 1ª bolla ottone (Ot)
12:14 - 2ª bolla Al
12:16 - 1ª bolla acciaio (Ac)
12:17 - 2ª bolla Ot
12:17 - 3ª bolla Al
12:20 - 3ª bolla Ot
12:28 - 4ª bolla Al
12:30 - 5ª bolla Al
12:30 - inizia la 2ª bolla Ac e la 4ª bolla Ot; si altera la scritta dell’alluminio.
Esperienza realizzata da Luciano Mancinelli
- 238967 letture
Fotosintesi
Il modo più semplice per vedere l'ossigeno prodotto dalle foglie è di fare come in queste foto. Le foglie, sia quella esposta al sole, sia quella tenuta al buio, sono immerse in acqua di rubinetto. L'esperienza è durata appena mezz'ora... e i risultati si vedono!

Esperimento avviato: una foglia si trova esposta alla luce del sole, l'altra al buio

Dopo mezz'ora confrontiamo i risultati

La foglia esposta ai raggi del sole si è ricoperta di bollicine

La foglia rimasta al buio non ha nessuna bollicina
Questa esperienza è stata ideata e descritta da Alfredo Tifi
- 32749 letture
Il filo con la memoria
Il Nitinol è una lega di nichel e titanio al 50% circa, scoperta per caso dal Naval Ordnance Laboratory circa 40 anni fa e caratterizzata dalla memoria di forma.
Da un filo di questa lega si può ricavare una forma, come per qualsiasi fil di ferro. La forma viene “fissata” mantenendo il filo a 500–550°C e raffreddandolo.
Ma a differenza di un normale filo d’acciaio, una volta distrutta la forma per stiramento, immergendolo in acqua calda o scaldandolo con un phon esso recupera repentinamente il motivo iniziale.

Il filo in figura riproduce la scritta ICE (Institute for Chemical Education)

Francesca stira il filo fino a farlo diventare completamente diritto…


Ma basta immergerlo in acqua calda perché esso recuperi istantaneamente la forma iniziale.
Il nitinol può esistere in due fasi, chiamate austenite (stabile a caldo) e martensite (stabile a freddo), con la stessa forma.
La deformazione a freddo provoca lo slittamento di regioni microscopiche di martensite l’una sull’altra, coinvolgendo distorsioni solo nelle zone di confine tra un dominio e l’atro. L’aumento di temperatura provoca il passaggio alla fase austenitica.
A causa della maggiore agitazione termica, le zone di tensione recuperano, a caldo, le posizioni originarie, stabili anche una volta raffreddato il filo alla temperatura ambiente e riportato alla fase martensite.
Esperienza proposta da Alfredo Tifi
- 14221 letture
Il perfetto equilibrista
Si tratta di una esperienza sui concetti di baricentro e di stabilità dell'equilibrio.
Nella semplice operazione di attaccare un quadro a una parete ricerchiamo in maniera intuitiva una soluzione che renda l’equilibrio stabile.
Se riflettiamo sulle operazioni che facciamo nell’attaccare un quadro possiamo spiegarci la “stranezza” del video che viene presentato in fondo a questa pagina.

Materiale
- un tappo di sughero;
- due forchette;
- la metà di uno stuzzicadenti.

Procedimento
Conficcare lo stuzzicadenti nella zona centrale di una delle basi del tappo

Conficcare le forchette nel sughero in modo più o meno simmetrico.
Abbiamo realizzato il nostro equilibrista.
Guarda il video dell'esperienza
Esperienza proposta da Natale
- 19647 letture
Il sommergibile




Quando il barattolo è inclinato verso l'alto, le monete non premono sul tappo e il sommergibile è in emersione.
Basta appoggiare il tappo sulle monete e premere per avere l'immersione; a causa della contrazione della piccola camera d'aria, il sommergibile scende e sale.
Guarda il video dell'esperienza
Esperienza proposta da Luciano Mancinelli
- 11485 letture
La forza dei magneti
Si tratta di una esperienza sul concetto di interazione a distanza.
Materiali
- olio di vasellina
- lana d'acciaio
- passino a maglie strette
- contenitore con coperchio
- forbici
- cucchiaino
- foglio bianco A4
- calamite.
Procedura
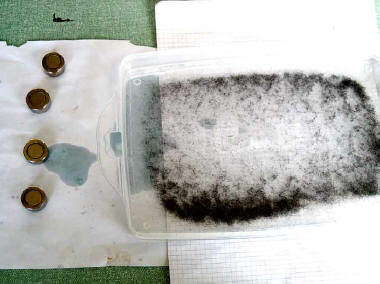
- Preparare la sottile limatura di ferro (se non la si ha a disposizione) sminuzzando con le forbici la lana d'acciaio, versandola nel passino e filtrandola sul foglio bianco.
- Disperdere il più possibile in maniera omogenea la lana nel contenitore, aggiungere delicatamente la vasellina in modo da coprire i pezzettini d'acciaio
- Chiudere il contenitore con il coperchio e, se la dispersione non è sufficientemente omogenea, provare a migliorarla muovendo dolcemente il contenitore.
- Disporre le calamite sul foglio bianco, mettere il contenitore (senza coperchio) sulle calamite.
- Osservare, disegnare e /o fotografare quello che succede anche quando si fa muovere il contenitore o le calamite sottostanti.





- 11783 letture
Leggerezza (pesantezza) del palloncino
Si tratta di un'esperienza sulla diversa densità dei materiali.
Il becker A contiene alcol: immergendo un piccolo palloncino con ghiaccio all’interno, queto si posiziona sul fondo.
Il becker B contiene acqua: immergendo un analogo palloncino, questo galleggia.

Mescolando i contenuti dei due becker, in quale posizione si vengono a trovare alcol, acqua e ghiaccio?
Qual è il più denso dei tre materiali?
Qual è il meno denso?




Esperienza proposta da Luciano Mancinelli
- 12427 letture
Magica acqua
Per raffreddare i corpi il miglior sistema è quello di immergerli in acqua: un ferro rovente immerso in acqua cede quasi istantaneamente la quantità di calore in eccesso. Questa proprietà dell’acqua è la chiave per capire come mai il palloncino contenente acqua, messo a contatto con la fiamma della candela, non esplode.
Guarda il video dell'esperienza
Sarebbe auspicabile realizzare l’esperienza con un palloncino gonfiato solo con aria e uno contenente acqua.
Ulteriore esperienza proposta
Due lattine contengono una acqua e l'altra olio. Come si fa a scoprire, con una piastra riscaldante, quale contiene acqua e quale olio?
Il problema può essere risolto mettendo le due lattine sulla stessa piastra e vedendo quale si riscalda più lentamente.
- 10414 letture
Palloncini
Tre palloncini sono riempiti con quantità di acqua diverse: quello bianco ne contiene una picccola quantità, quello arancione una quantità intermedia, quello giallo una quantità maggiore.
Inizialmente i palloncini sono immersi in acqua fredda (a 15 °C).
Guarda il video dell'esperienza
I tre palloncini vengono tolti dall'acqua a 15° e immersi nell'acqua a 45°. Tutti e tre vanno a fondo.
Il palloncino bianco, all'estrema destra, sale piuttosto rapidamente.
Poi comincia a salire anche il palloncino arancione che conteneva una quantità di acqua intermedia.
Infine, anche il palloncino giallo comincia a muoversi. La temperatura dell'acqua è scesa a 40°. Dopo due minuti, il palloncino giallo (con un volume d'acqua maggiore) si è riscaldato, sta salendo e raggiunge la superficie.
Esperienza proposta da Luciano Mancinelli
- 9670 letture
Pippopopotamo e il mistero della subsidenza
Se si sottopone a una piccola vibrazione il vaso di sabbia, subito dopo il nostro “pippopopotamo” inizia a sprofondare. Ha forse mangiato troppo? In effetti, guardandolo bene all’interno, si troverebbe che è imbottito di pallini di piombo. Ma questo non basta a spiegare la magia. Un suggerimento: tenete d’occhio il livello della sabbia!



L’esperimento fa uso di un semplice imbuto, chiuso da una pila a stilo, infilata dall’interno e cementata da un po’ di sabbia umida lasciata seccare, come illustrato dalla seguente sequenza di immagini.

La pila è infilata senza forzarla nell'imbuto...

... e tenuta bloccata da un po' di sabbia bagnata

Si adagia l'imbuto sul fondo del barattolo...

... e si copre di sabbia fino alla sommità.
Imprimendo una piccola vibrazione al barattolo, si provoca il distacco della sabbia che sostiene la pila, la quale cade nello spazio vuoto dell’imbuto che, in alcuni secondi, si riempie della sabbia soprastante, trascinando con sé il pesante animale.
Il fenomeno di rottura della crosta sabbiosa, a causa di uno spazio vuoto sottostante, si chiama subsidenza, ed è abbastanza frequente nei deserti. A causa dei venti che soffiano la sabbia in una direzione costante, si creano delle cornici di crosta sabbiosa che sovrastano grosse bolle d’aria e che sono instabili. Le jeep o i dromedari rischiano di essere inghiottite allo stesso modo del nostro “pippopopotamo”. Il fenomeno può anche avere origini non naturali, quando la bolla d’aria è causata dall’estrazione del petrolio o dal pompaggio di acqua sotterranea.
Guarda il video dell'esperienza
Esperienza realizzata da Luciano Mancinelli
- 10165 letture
Trasformazioni chimiche
Questa esperienza rappresenta una unità didattica completa, che presenta alcuni esempi di possibili cambiamenti nella struttura degli aggregati di atomi che si verificano nelle trasformazioni chimiche e costituisce un supporto per rendere trasferibile e ripetibile l’esperienza, nell’ambito di un percorso più completo sulla struttura della materia, che parte dal modello particellare.
Prerequisiti
Nozioni di base riguardo a:
- modello particellare
- concetti di atomo, molecola, elemento e composto
- concetti di miscuglio, soluzione e sostanza chimica.
Obiettivi
- Costruire delle rappresentazioni degli aggregati atomici e delle loro trasformazioni.
- Esplorare e classificare i diversi possibili modi di ri-assemblarsi di tali aggregati.
- Riconoscere le evidenze delle trasformazioni delle sostanze nei fenomeni chimici.
- Stabilire un’associazione tra le immagini mentali dei cambiamenti degli aggregati di atomi e i rispettivi cambiamenti delle proprietà delle sostanze coinvolte nelle trasformazioni chimiche.
Materiali
- Costruzioni Lego di almeno 4 colori (le “Duplo” sono meglio visibili e più facilmente smontabili).
- Per la reazione zinco + iodio: limatura di zinco granulare (non in polvere), iodio a cristalli o soluzione di tintura di iodio, aceto, provetta con tappo a vite o altro recipiente trasparente che si possa chiudere.
- Per la reazione di decomposizione dell’acqua ossigenata: acqua ossigenata al 3 %, biossido di manganese (polvere nera contenuta nelle pile a secco), palloncino di gomma, bottiglia o beuta da 125 mL.
- Per la reazione di decomposizione dello ioduro di zinco: una pila da 9 V con portapile e due lamine di rame, un recipiente largo (per esempio piastra Petri), ioduro di zinco preparato precedentemente o una sua soluzione.
- Per la reazione alluminio + cloruro rameico: lamina di alluminio (per esempio presa da una casseruola di alluminio per forno), cloruro rameico, acqua distillata; se si dispone di solfato rameico (più facilmente reperibile) si può sciogliere prima il sale da cucina nell’acqua distillata per avere la stessa reazione.
- Per la reazione bicarbonato + aceto: bottiglia, palloncino di gomma, aceto, bicarbonato di sodio, cucchiaio, cartina del pH.
Concetti fondamentali
Una sostanza corrisponde a un aggregato di atomi. Negli elementi gli aggregati contengono solo atomi dello stesso tipo.
 |
 |
 |
| a) Elemento con atomi non aggregati | b) elemento con atomi associati a coppie | c) elemento con atomi aggregati in una struttura compatta |
Nei composti ci sono invece ripetizioni regolari di abbinamenti tra atomi diversi.
 |
 |
 |
| a) Aggregazioni di due atomi diversi formano le molecole di un composto AB | Un composto AB formato da due elementi diversi dal precedente] | c) Composto formato da un aggregato compatto di atomi disposti regolarmente |
 |
 |
 |
| d) Molecole uguali di un composto AB2 | d) Aggregazione solida degli atomi in un composto di tre elementi | e) altro composto solido formato da atomi di due elementi |
In ogni caso, se gli atomi si uniscono a formare gruppetti separati l’uno dall’altro, tali aggregati si chiamano molecole. È importante precisare non solo quali atomi formano le molecole, ma anche come sono disposti. Le molecole di destra nell'immagine qui sotto sono diverse da quelle di sinistra, e le corrispondenti sostanze avranno proprietà diverse.

Se si modificano il numero e la disposizione degli atomi negli aggregati, cioè se si modifica il loro modo di stare uniti, cambiano tutte le proprietà della sostanza, comprese quelle che possiamo vedere con i nostri occhi.
Una sostanza ha numerose proprietà. La seguente tabella mostra le proprietà di due composti: l’acido acetico (principale componente dell’aceto) e il bicarbonato di sodio.
| Proprietà | Acido acetico | Bicarbonato di sodio |
| Stato fisico a 20 °C | Liquido | Solido |
| Effetto del riscaldamento | Fonde a 16 °C e bolle a 118 °C | Si decompone liberando anidride carbonica a 270 °C trasformandosi in carbonato di sodio |
| Solubilità in acqua | Illimitata | 90 grammi/litro |
| Solubilità in alcol | Illimitata | Insolubile |
| Densità | 1,05 g/cm3 | 2,16 g/cm3 |
| Colore con la cartina del pH | Rosso (acido) | Blu (basico) |
| Reazione con aceto | --- | Sviluppa effervescenza |
| Reazione con bicarbonato | Sviluppa effervescenza | --- |
Le particelle singole non possiedono quasi nessuna di queste proprietà: un singolo atomo non può essere né solido né liquido né gassoso, non fonde né bolle, non si scioglie e non ha colore. Queste sono tutte proprietà che possono avere solo gli aggregati formati da molte particelle, non i singoli atomi o le singole molecole.
Le ultime tre proprietà della tabella e la capacità di decomporsi a caldo del bicarbonato sono proprietà chimiche, perché riguardano la capacità di originare nuove sostanze.
Nelle trasformazioni chimiche si modifica il modo di aggregarsi degli atomi e perciò emergono nuove sostanze, i prodotti, con proprietà completamente diverse da quelle delle sostanze iniziali, i reagenti. Le prove più comuni e visibili di queste trasformazioni sono:
- cambiamenti di colore
- formazione di bollicine (effervescenza)
- formazione o scomparsa di solidi unendo due liquidi
- aumento o diminuzione della temperatura
Qualsiasi cambiamento delle proprietà può essere in genere associato alla comparsa o alla scomparsa di una sostanza. Fanno eccezione i passaggi di stato e la formazione di soluzioni, in cui si possono verificare cambiamenti di colore, formazione o scomparsa di solidi o gas e cambiamenti di temperatura senza che si formino nuove sostanze. In questo tipo di trasformazioni, chiamate trasformazioni fisiche, le sostanze coinvolte conservano alcune proprietà e inoltre esse possono essere recuperate nella forma iniziale, ripristinando le condizioni di temperatura e pressione iniziali o eliminando il solvente se erano state sciolte.
Ma cos’è che provoca le trasformazioni chimiche? Ovvero, perché semplicemente associando due sostanze, o somministrando energia a una sola sostanza, si innesca la formazione di nuove sostanze?
Il modello particellare fornisce due indizi per rispondere a questa domanda. Secondo tale modello le particelle sono soggette a un movimento tanto più frenetico quanto maggiore è la temperatura. Il semplice riscaldamento di una sostanza può quindi provocare la frammentazione in aggregati più piccoli. Il modello particellare prevede inoltre che le particelle e gli atomi si attraggano, cioè abbiano affinità gli uni per gli altri. L’agitazione termica garantisce una certa libertà, agli atomi degli aggregati, di staccarsi parzialmente per “esplorare” nuove combinazioni, alcune delle quali daranno attrazioni più forti. Si può dire che un sistema chimico somiglia ad una sala da ballo, dove entrano molte coppie che possono sperimentare nuovi partner, e dalla quale escono coppie diverse e più “affiatate”. Vediamo ora il comportamento di alcuni sistemi chimici.
Reazione zinco + iodio
Introdurre nel recipiente circa 1 g di zinco, circa 5 mL di acqua e infine circa 1 g di iodio solido. Se non si dispone di questo è possibile sostituire l’acqua con la tintura di iodio. Aggiungere qualche goccia di aceto. Chiudere la provetta ed agitare a lungo.
Se si parte da zinco solido, il liquido prima diventerà più scuro, divenendo simile alla tintura di iodio. Lo iodio in soluzione reagirà più rapidamente con lo zinco e dopo circa 5 minuti si osserverà una rapida decolorazione, fino a un colore giallo chiaro.
La soluzione può essere travasata in un becher, lasciando l’eccesso di zinco nella provetta, e fatta evaporare su una piastra termica fino a isolare il prodotto dell’unione dei due elementi, cioè il composto ioduro di zinco.
| Il fenomeno in concreto | Il modello |
|
|
|
| Con l’evaporazione dell’acqua le particelle del composto di iodio e zinco possono aggregarsi e formare un solido. A destra modello di ioduro di zinco solido. |  |
Altri sistemi chimici che seguono lo stesso modello sono, per esempio, la combustione del magnesio e la formazione della ruggine.
Reazione alluminio + cloruro rameico
Sciogliere due cucchiaini rasi di cloruro di rame in mezzo bicchiere di acqua distillata, per avere una soluzione limpida. Introdurre nella soluzione una lastrina di alluminio, ottenuta ritagliandola da una casseruola in tale materiale. Da notare che il foglio di alluminio per avvolgere gli alimenti è troppo sottile e si disgrega completamente, quindi l’eccesso di tale elemento non può essere separato facilmente a fine reazione.
Osservare tutti i fenomeni che accompagnano la trasformazione. In questa trasformazione un elemento ne sostituisce un altro combinato in un composto, producendo un nuovo composto e un altro elemento.
Una reazione secondaria, dello stesso tipo, interessa l’alluminio (elemento) e l’acqua (composta da idrogeno e ossigeno): l’alluminio sostituisce l’idrogeno e si combina con l’ossigeno. L’idrogeno, rimasto senza “partner”, si libera sotto forma di bollicine.
 |
 |
 |
|
| Chiave: bianco = alluminio, giallo = cloro; rosso = rame. | |
Decomposizione dell'acqua ossigenata
In una bottiglietta introdurre metà volume di acqua ossigenata (perossido di idrogeno) al 3%. Si può notare che da tale soluzione si liberano alcune bollicine (il disinfettante scade e perde di efficacia dopo uno o due anni). Aggiungere poi un cucchiaino di polvere nera di biossido di manganese. Chiudere subito il collo della bottiglia con un palloncino di gomma e agitare.
Il gas prodotto farà gonfiare il palloncino. Facendo uscire un po’ di tale gas e dirigendolo su un pezzetto di legno incandescente appena spento, si ravviverà la combustione. La capacità di ravvivare la combustione è una proprietà dell’ossigeno, prodotto dalla decomposizione dell’acqua ossigenata.
Il biossido di manganese ha solo la funzione di accelerare la decomposizione dell’acqua ossigenata, che si verifica anche spontaneamente. Il biossido di manganese non si trasforma in altre sostanze, infatti, una volta terminata l’effervescenza, si può recuperarlo e utilizzarlo quante volte si desidera con altra acqua ossigenata.
In questa reazione accade che un composto si suddivide in un composto più semplice e in un elemento.
| Il fenomeno in concreto | Il modello |
 |
acqua ossigenata
acqua + ossigeno |
In genere le reazioni di decomposizione sono provocate dalla somministrazione di energia (termica, elettrica, luminosa) come nel caso della decomposizione dello ioduro di zinco.
Decomposizione dello Ioduro di zinco (con elettricità)
Sciogliere in un becher o in una piastra di Petri lo ioduro di zinco ottenuto dalla reazione tra iodio e zinco, o usare direttamente la soluzione di questo composto ottenuta nell’esperienza sopra descritta. Immergervi due lamine di rame collegate al polo positivo e negativo di una batteria da 9 V.
Al polo positivo si formerà la colorazione bruno-rossiccia dello iodio, al polo negativo si formeranno dei cristalli lucenti metallici e grigi, di zinco. Quindi gli stessi due elementi possono essere uniti in un composto e poi separati fornendo energia.
| Il fenomeno in concreto | Il modello |
|
Dalla soluzione del composto si rigenerano gli elementi iodio (al polo positivo, rosso) e zinco metallico (al polo negativo, nero). |
|
Reazione acido acetico + bicarbonato di sodio
In una bottiglietta introdurre due cucchiai di bicarbonato di sodio, versarvi aceto senza superare la metà del volume e chiudere subito con il palloncino di gomma. Il gas prodotto lo gonfierà.
Quando la reazione è terminata il liquido non conterrà più acido acetico. Senza far sgonfiare il palloncino scaricare il liquido e verificare con la cartina indicatrice che esso non è più acido come l’aceto iniziale. Aggiungere altro aceto e richiudere con lo stesso palloncino, che si gonfierà ulteriormente del gas sviluppato (anidride carbonica). Il liquido ottenuto, separato dal bicarbonato in eccesso, può essere evaporato. Si otterrà una sostanza che non ha più la capacità di dare effervescenza con acido acetico: l’acetato di sodio.
In questa reazione da due composti si originano altri due composti. Fanno parte di questa categoria tante altre reazioni, come quella tra cloruro rameico e idrossido di sodio, in cui si forma cloruro di sodio (sale da cucina) e idrossido rameico, un solido blu insolubile in acqua.
| Il fenomeno in concreto | Il modello |
 |
|
| L’anidride carbonica ha formula CO2 e nel modello dei prodotti la sua molecola corrisponde al mattoncino nero con due rossi. Il bicarbonato di sodio, formato da quattro elementi, ha struttura più complessa. | |
Ioduro di mercurio (riscaldato)
Questo composto rosso vivo, se riscaldato sopra i 130 °C, subisce un riarrangiamento interno dei suoi atomi.
Alla nuova disposizione corrisponde una evidente diversa proprietà: il colore che diviene giallo. A temperatura ambiente si rigenera l’aggregazione atomica originaria e il colore torna rosso.
Lo ioduro di mercurio è ottenibile per combinazione diretta degli elementi iodio e mercurio.
| Il fenomeno in concreto | Il modello |
|
Composto HgI2 in condizioni normali, a temp. ambiente |
 |
|
Riscaldandolo a più di 127 °C si modifica il modo di stare insieme dei suoi atomi e cambiano le sue proprietà, compreso il colore e la densità (5% meno denso) |
 |
|
A temperatura ambiente, a poco a poco, si ripristina l’arrangiamento iniziale, più compatto. A destra il modello presenta alcune zone compatte e altre che devono ancora riarrangiarsi |
 |
Tutte le reazioni chimiche descritte, tranne l’ultima, sono state realizzate dal tutor Alfredo Tifi presso la seconda media dell’Istituto Comprensivo di Appignano il 28 maggio 2004, con l’insegnante Valeria Bellucci.
- 105349 letture